Znajdź zawartość
Wyświetlanie wyników dla tagów 'czystość' .
-

Brettanomyces kontra środki dezynfekujące, kto wygra?
DanielN opublikował(a) temat w Artykuły i opracowania
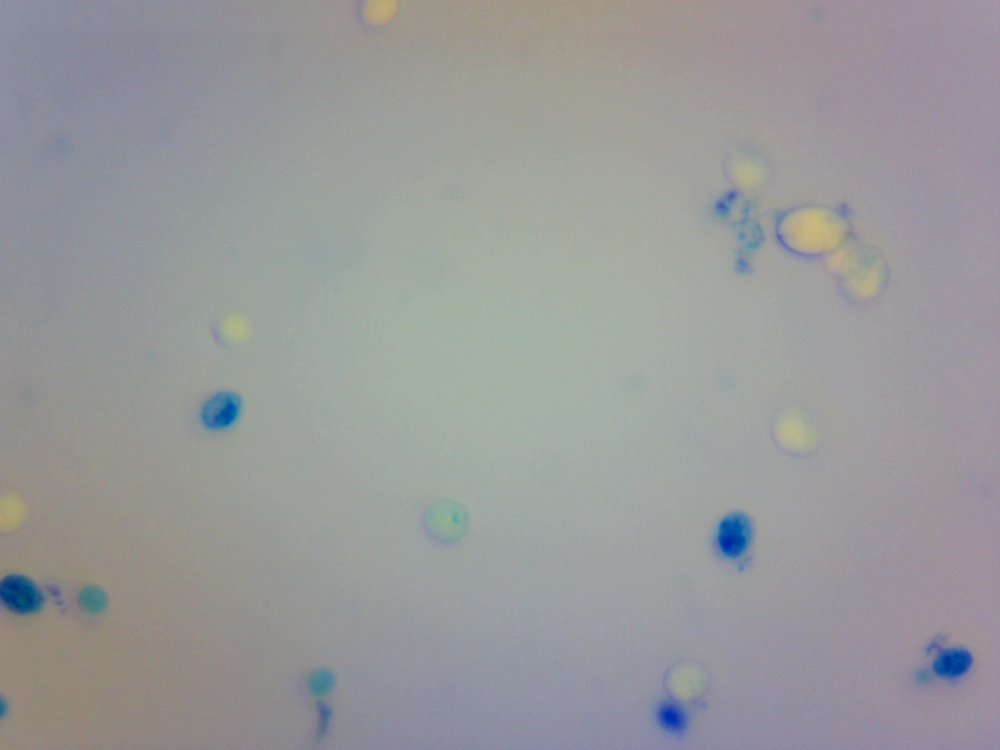
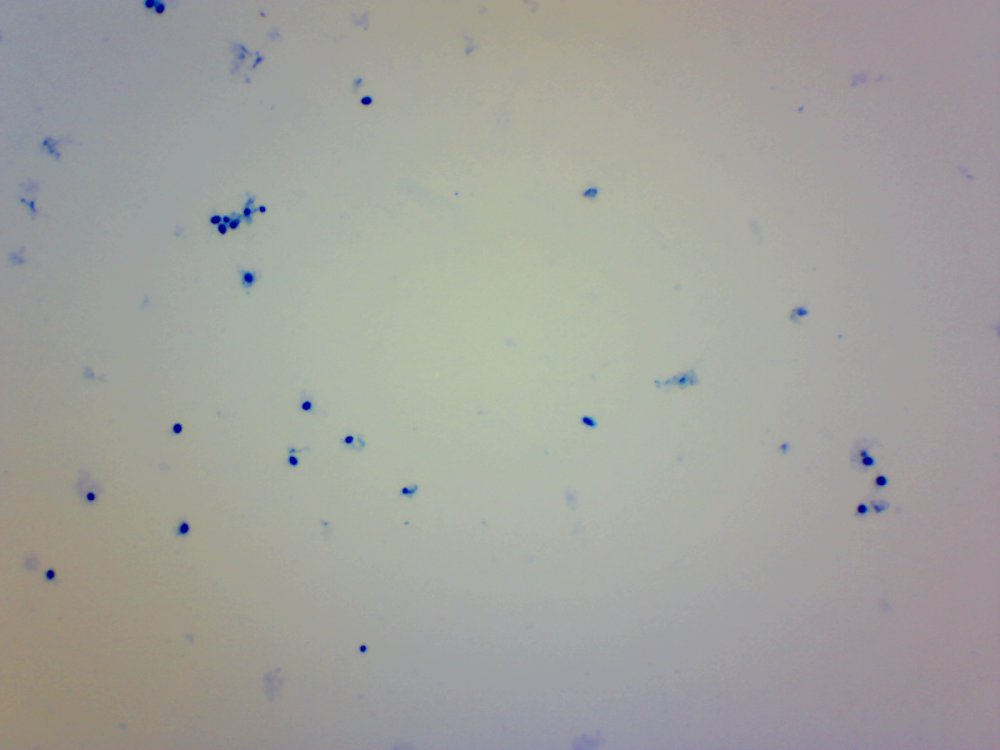
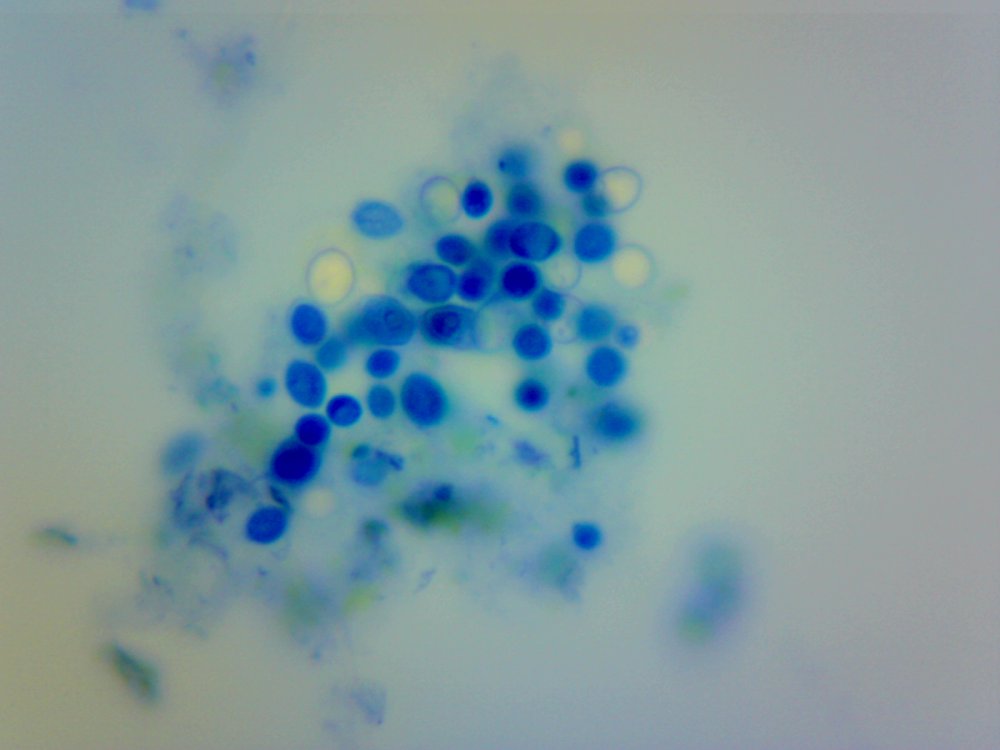
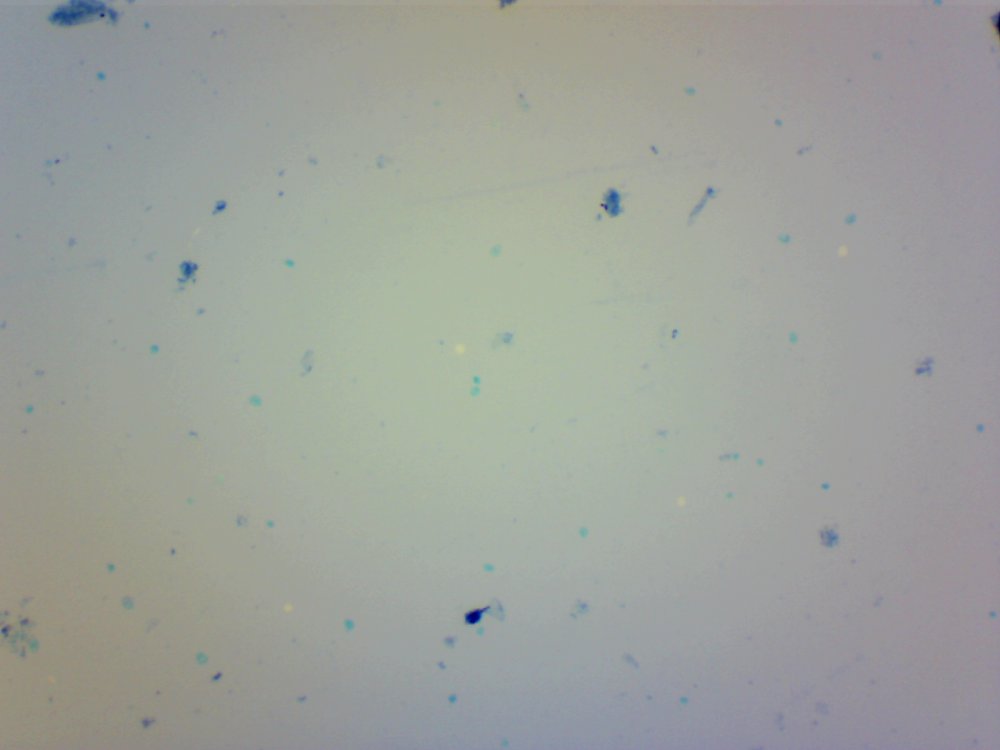
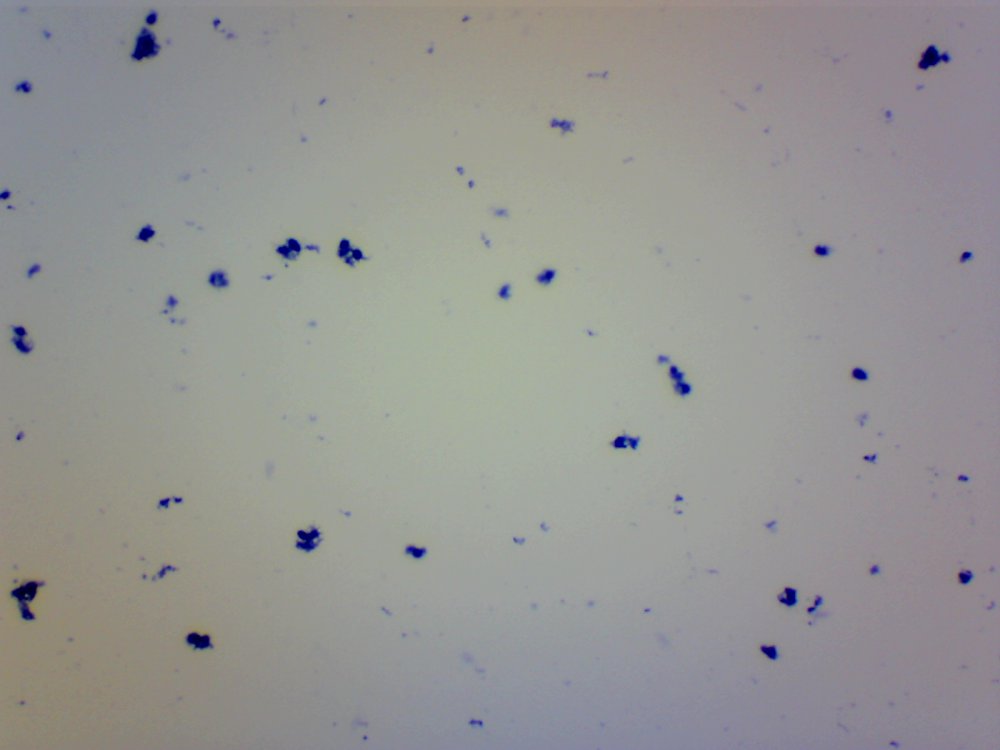
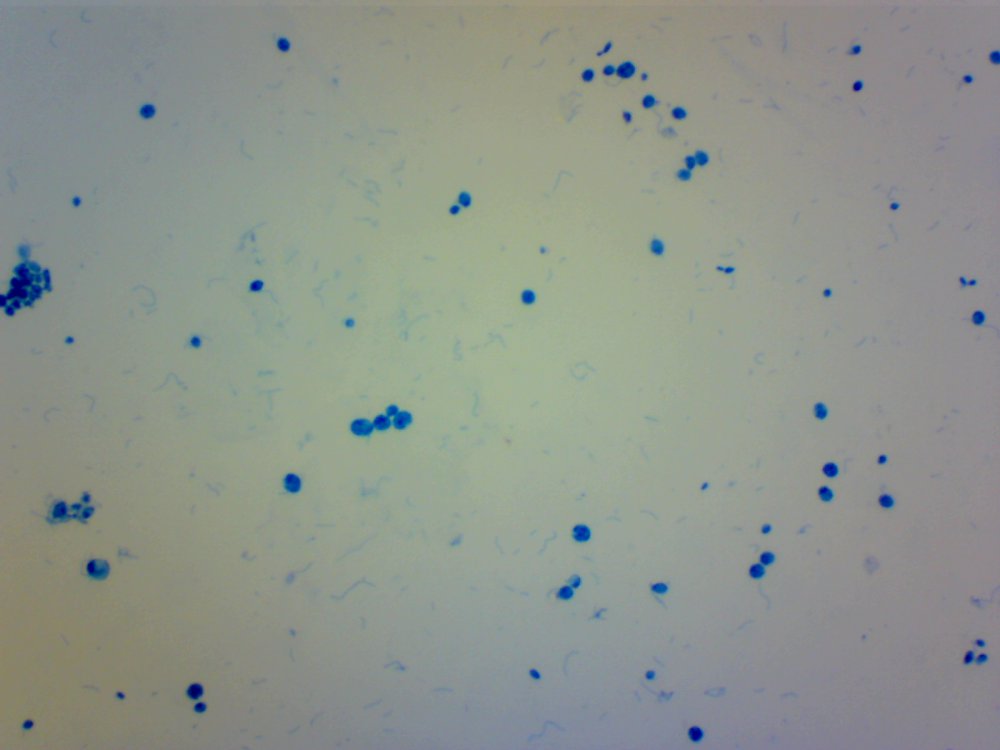
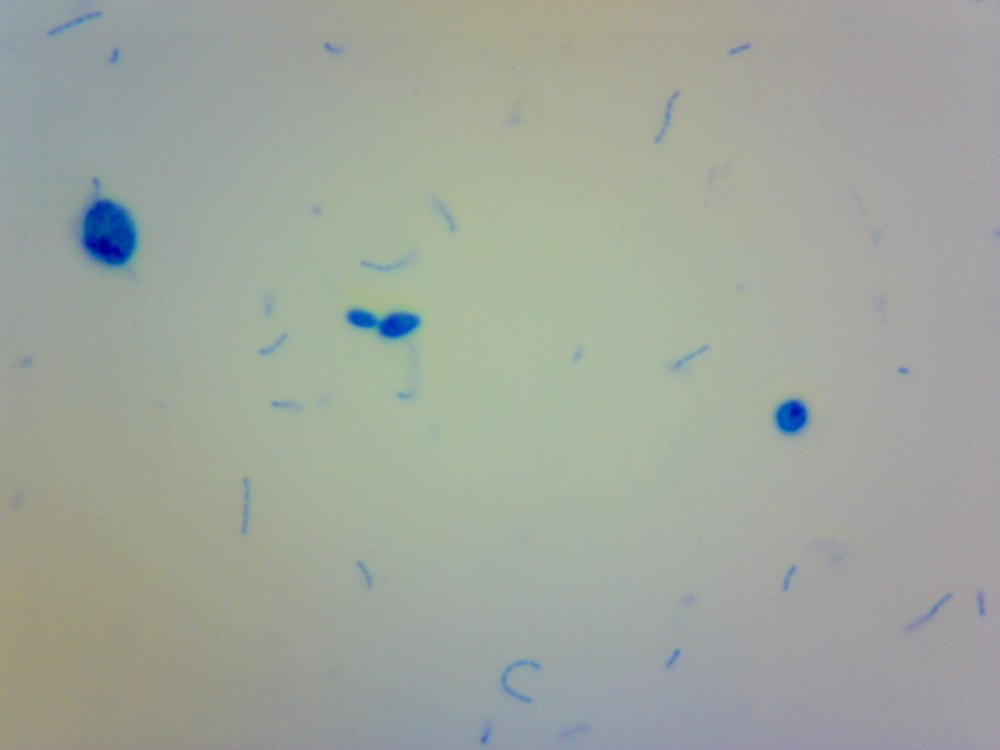
Cześć. Przeczytanie wpisu zajmie Ci poniżej 10 minut. Jeżeli wymieniamy atrybuty piwowara domowego to czystość jest na pierwszym miejscu. Czystość browaru domowego jest w kontekście minimalizacji kontaminacji/zakażenia brzeczki. Czystość oznacza mycie, sanityzację, dezynfekcję czasem również sterylizację. Długo zbierałem się by zrobić to doświadczenie. Chciałem sprawdzić skuteczność najbardziej popularnych środków dezynfekujących używanych w naszych browarach domowych na drożdże Brettanomyces. @Maciejeq jakiś czas temu dostarczył mi gęstwę Lochristi Brettanomyces Blend THE YEAST BAY. Jest to blend kilku szczepów Brettanomyces, jeżeli środki są skuteczne to nic (wg. podręczników to 99.999%) w gęstwie nie ma prawa przeżyć. Podczas tego doświadczenia ucierpiały miliardy komórek drożdżowych i jedne szorty męskie, takie za kolano. Środki które sprawdziłem to: StarSan, miałem o to wiele pytań. Użyłem 2 mililitrów StarSanu rozpuszczonego w 1 litrze wody demineralizowanej. Kwas fosforowy (V), inaczej ortofosforowy. Ten który kupiłem ma wagowe stężenie 75%. Swój rozcieńczyłem do 5% wagowo ( @dziedzicpruski, w nawiązaniu do którejś z dyskusji, powtórzyłem eksperyment dwa razy z kwasem) Nadwęglan Sodu (Na2CO3·1.5H2O2), w naszym świecie to OXI. W jednym litrze wody demineralizowanej rozpuściłem 2 gramy, podobno tyle jest skuteczne. Soda Kaustyczna, NaOH, właściwości dezynfekcyjne wg podręczników posiada od stężenia 2 molowego. Mol NaOH waży około 40 gramów, zatem w 1 dm^3 roztworu powinno znajdować się 80 gramów NaOH. Odmierzyłem 80 gramów i dopełniłem do 1 litra wodą demineralizowaną. Wszystkie wyżej wymienione środki są kontaktowe. Zatem drożdże muszą mieć kontakt z samym środkiem a nie oparami. Materiałem wejściowym jest płynna gęstwa, która wpływa na stężenie środka dezynfekującego. Dodatkowo samej gęstwy nie da się podglądać pod mikroskopem, będzie to po prostu komórka na komórce i rozmyty obraz. Wszystko by pływało i obserwacja byłaby utrudniona. Zatem upiekę dwie pieczenie na jednym ogniu. Aby zminimalizować rozcieńczenie środka dezynfekującego pobieram bardzo niewielką próbkę gęstwy i dużo środka dezynfekującego, w końcu to środek kontaktowy, niech drożdże w nim pływają. W ten sposób rozcieńczam samą próbkę, obserwacja jest możliwa i wygodna. Środek dezynfekujący traci swe właściwości w stopniu minimalnym. Po czasie kontaktu brałem małą próbkę, dodawałam barwnik i robiłem preparat mikroskopowy. Starałem się preparat robić w przeciągu dwóch minut, wtedy wpływ samego barwnika na wynik jest mały. Drożdże Brettanomyces używane są w piwowarstwie w sposób zamierzony i niezamierzony. Te niezamierzone obrosły w legendę jakoby miały nogi, były nieśmiertelne, przenikały przez ściany, miały lasery i pewnie znajdzie się jeszcze kilka innych opowieści. Drożdże Brettanomyces używane w przemyśle spożywczym na mój stan wiedzy nie tworzą zarodników. Te dzikie (inne gatunki Dekkera), które rzadko robią coś dobrego w brzeczce już mogą. Doświadczenie jest oparte o blend używany w piwowarstwie. Zatem pozostaje czas i miejsce na dalsze eksperymenty. Gęstwa spędziła u mnie w lodówce ponad 6 tygodni, nie miałem wcześniej czasu aby do nich przysiąść. Rozcieńczyłem ją jedynie na początku solą fizjologiczną aby lepiej zniosły czekanie. Zniosły to całkiem nieźle, patrząc całokształtem ponad połowa jest żywa. Tutaj małe wyjaśnienie jak patrzeć na obrazy mikroskopowe. Komórki wybarwione na niebiesko są martwe. Testem, który sprawdza czy komórka drożdżowa jest żywa jest próba jej wybarwienia, np.: za pomocą błękitu metylenowego. Jeżeli jest żywa, to silna membrana nie przepuści barwnika i sama komórka pozostanie kremowo biała. Błękit metylenowy, którego używam jest toksyczny dla komórek i po kilkunastu/kilkudziesięciu minutach przenika i zabiją komórkę, dlatego trzeba się śpieszyć i wiele rzeczy zgrywać w czasie. Materiałem jest gęstwa po piwie APA, oprócz samych drożdży będzie również widać wiele różnych drobin, np chmielu, osadów białkowych itp itd. Te będą barwić się na niebiesko. Gęstwa wygląda tak. Powtarzam, że żywych komórek drożdżowych jest trochę więcej jak martwych. Pojedynek pierwszy: Brettanomyces kontra StarSan Rozpuściłem 2 ml Star Sanu w 1 litrze wody demineralizowanej. Środek działa kontaktowo. Jako pojemnik służy mi strzykawka 2 ml. Odebrałem 0.2 ml gęstwy i dopełniłem do 2 mililitrów roztworem Star Stanu. Star San w składzie zawiera kwas ortofosforowy, alkohol izopropylowy, który wg mnie działa tutaj jako rozpuszczalnik, środki powierzchniowo czynne, odpowiedzialne za pienienie i jakiś składnik patentowy. Czas kontaktu 5 minut. Potem szybko do wybarwienia, na preparat i pod mikroskop. Powiększenie 100x, latałem, szukałem nie znalazłem ocalałych. Star San z tej walki wychodzi z tarczą, Brettanomyces poległy. Pojedynek drugi: Brettanomyces kontra Nadwęglan Sodu (Na2CO3·1.5H2O2), aka OXI. Sprawił mi trochę problemów, ze względu na to że wydziela H202, pod preparatem miałem bąbelki i utrudnioną obserwację. Rozcieńczyłem 2 gramy Nadwęglanu Sodu w 1 lirze wody demineralizowanej. Zostawiłem na mieszadle i w kilka minut się rozpuścił. Ponownie pobrałem 0.2 ml gęstwy i dopełniłem do 2 mililitrów środkiem dezynfekującym. Czas kontaktu 10 minut. Barwienie, potem preparat i pod mikroskop: Powiększenie 400x, udało mi się znaleźć żywe komórki w skupiskach/zbitkach drożdży. Po czasie kontaktu, 15 minutowym nadal były żywe komórki, ale było ich zdecydowanie mniej. Zatem trzeba by było albo zwiększyć dawkowanie, ale wtedy mamy ten niefajny osad lub wydłużyć czas. Tym razem z tarczą wracają Brettanomyces. Pojedynek trzeci: Brettanomyces kontra Kwas fosforowy (V), ortofosforowy, 5% wag. Tak samo jak poprzednio. Odebrałem 0.2 ml gęstwy, dopełniłem strzykawkę do 2 mililitrów. Czas kontaktu podobnie jak w przypadku StarSanu, 5 minut. W końcu kwas fosforowy (V) to jego główny składnik. Powiększenie 100x, jeżeli przyjrzysz się uważnie to zauważysz żywe pojedyncze komórki. Również wiele komórek jest blado niebieskich, barwnik zaczyna w nie wnikać. Z samym kwasem trzeba by było przeprowadzić dalsze eksperymenty. Może wydłużyć czas ekspozycji, albo zwiększyć stężenie. Jako, że sprawdzam blend, to może któryś typ, pewnie mylę taksonomie, drożdży się opiera. Ciekawostka, w zbitkach drożdżowych, nie znalazłem, żadnych żywych, przeżyły tylko pojedyncze sztuki. W tym pojedynku kolejny raz z tarczą wychodzą Brettanomyces. Pojedynek czwarty: Brettanomyces kontra Soda kaustyczna NaOH, zasady ponad wszystko! ;). Roztwór 80 gramów sody kaustycznej dopełniony do jednego litra wodą demineralizowaną. Czas ekspozycji 10 minut. Nie udało mi się znaleźć żywej komórki. Nie wiem czy to zasługa sody kaustycznej ale wszytko barwiło się bardziej na niebiesko w połączeniu z NaOH. Zwycięża i wychodzi z tarczą NaOH. Mały bonus. Do mycia fermentorów używam roztworu ~1 molowego, czyli 40 gramów NaOH w litrze wody. Już takie stężenie powodowało, że nie mogłem znaleźć żywych komórek drożdżowych. W podręcznikach podawany jest roztwór 2 molowy, ponieważ oprócz drożdży są również bakterie, przetrwalniki i zarodniki. Sprawdzałem również mój środek oparty na alkoholu medycznym oraz izopropanolu. Roztwór 70% robiony chałupniczo gdzie litr takiego środka kosztuje +/- 10zł za litr, bretty również nie miały żadnych szans. Uwaga. Powyższe doświadczenie nie może być traktowane jako wyrocznia, kolejny raz powtarzam, że nie jestem ani chemikiem ani biologiem, mogłem i zapewne coś zrobiłem źle, a już na pewno nie do końca metodologicznie. Doświadczenie jest subiektywne w kontekście mojego browaru domowego. Nie wiem jak Ty, ale ja zostaje przy NaOH + Star San. No chyba, że PBW będzie kiedyś w rozsądnej cenie. Kilka słów na koniec. Powyższe doświadczenie chciałem oprzeć na większej ilości szczepów, zwłaszcza na mikroflorze która jest w naszych piwach. W tym celu @Undeath przesłał mi kilka zakażonych piw. Zebrał je podczas sędziowania na różnego rodzaju konkursach. Niestety okazało się, że we wszystkich przypadkach ilość żywych komórek drożdżowych nie przekracza 10%. Nie było sensu robić doświadczeń. Żywotność była w bardzo słaba. Z drugiej strony, tak sobie głośno myślę, że nawet dobrze się stało, bo bym z tymi wszystkimi osadami z piw musiałbym siedzieć kilaka dni, tyle czasu to nie mam. Poniżej wybrałem jeden egzemplarz zakażonego piwa, ze względu na dobrze widoczne mikroby. Powiększenie 100 krotne, zwróć uwagę na tło. W każdym naszym piwie można znaleźć bakterie, jednakże są to pojedyncze przypadki w porównaniu do ilości drożdży. Tutaj jest zdecydowanie odwrotnie. Piwo miało być stylem American Pale Ale, ale bakterie postanowiły inaczej. Piwo pachniało kapustą kiszoną i cebulą, na bank Citra , do tego w tle estry brettowe i spacer po stajni. Próbka nie była traktowana żadnymi środkami dezynfekującymi, po prostu piwo się tak zakwasiło, że zginęło w nim prawie wszystko. Bakterie mają to do siebie, że wytwarzają wiele związków blokujących inne formy życia. W tym małym świecie jest również wyścig zbrojeń i każdy chce wygrać. Będę szczery, po praz pierwszy miałem do czynienia z tak wadliwym piwem, musiałem się zmusić do spróbowania. W smaku kwas w kierunku octu, apteczna goryczka. Przełączyłem rewolwer mikroskopu na obiektyw 40x uzyskując powiększenie 400x. Tak wygląda zakażone piwo. Bakterii jest zapewne o rząd wielkości więcej aniżeli drożdży. Długie pałeczki to prawdopodobnie lactobacillus, krótsze pałeczki i kropki mogą być pediococcusem. To tylko domniemania. Nie można tego jednoznacznie stwierdzić, przynajmniej na moim zabawkowym mikroskopie. Do identyfikacji, trzeba użyć bardziej zaawansowanych metod jak posiewy na selektywnych/filtrujących podłożach. Względnie drogiego sprzętu i innych metod wizualizacji. Mam nadzieję, że post Ci się podobał.- 40 odpowiedzi
-
- nadwęglan sodu
- czystość
-
(i 6 więcej)
Oznaczone tagami: