Znajdź zawartość
Wyświetlanie wyników dla tagów 'enzymy' .
-

Próba jodowa. Jak to działa? robić czy nie robić?
DanielN opublikował(a) temat w Artykuły i opracowania
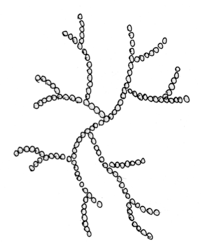
Próba jodowa Jak to działa? robić czy nie robić? Zanim zacznę, przedstawię kilku forumowiczów którzy dbają o poziom tego co czytacie. Kantor, ogromne dzięki, że zechciałeś kolejny raz zrecenzować artykuł i jak zawsze podnieść jakość merytoryczną. Dobrze mieć człowieka związanego z chemią w szeregu piwowarów. Kolejny raz dzięki Oskaliber i Undeath za krytyczne oko praktyka. Nie mogę też zapomnieć o podziękowaniach dla żony, która już chyba ma trochę dość czytania o piwie, to dzięki jej poprawkom stylistycznym można to w ogóle czytać. W Internecie jest wiele źródeł o tym, jak przeprowadzić test na obecność skrobi za pomocą jodyny. Jeżeli badana próbka zmieniła kolor, to znaczy, że skrobia jest obecna i trzeba dalej zacierać. Współczesne słody, zwłaszcza te mocno rozluźnione, potrafią już po 10-15 minutach pokazać negatywną próbę jodową. Nie ma skrobii, to po co zacieramy tak długo? Czy nie pora wysładzać? Na te pytania postaram się odpowiedzieć. Opiszę Ci jak działa próba jodowa i mam nadzieję, że przekonasz się, że warto poczekać dłużej z zacieraniem. W tym celu trzeba przypomnieć co to jest skrobia w rozumieniu piwowara domowego. Skrobia jest polimerem, w zasadzie biopolimerem, a jeszcze dokładniej polisacharydem. Przedrostek ‘poli’ oznacza, że związek składa się z wielokrotnie powtórzonych jednostek zwanych merami. Stąd polimer. W skrobi merem jest cząsteczka glukozy. Zatem skrobia to wielocząsteczkowy związek, który składa się z powtarzających się cząsteczek glukozy. Ale żeby było ciekawiej, to w skrobi występują dwie frakcje: Amyloza, są to długie nitki glukozy. W skrobi pochodzącej ze słodów mogą liczyć liczyć nawet 2000 cząsteczek glukozy w jednym rzędzie. Cząsteczki glukozy połączone są jedna za drugą, budując długą wstążkę. Co ciekawe, odpowiednio długa wstążka zaczyna się skręcać w spiralę. Ta właściwość, jak się zaraz okaże, jest kluczowa do przeprowadzenia próby jodowej. Na pełny obrót spirali przypada 6 cząsteczek glukozy. W zależności od źródła skrobi, amyloza stanowi około 10-30% jej masy. W przypadku słodu jęczmiennego około 20%. Wygląda to tak jak na poniższym obrazku. Te sześciany wewnątrz to cząsteczki glukozy połączone atomem tlenu. Amylepektyna, jest o wiele bardziej złożona. Składa się z ogromnej ilości cząsteczek glukozy, dochodzącej nawet do 200 tysięcy. Amylopektyna jest rozgałęzionym tworem. W skrobi pochodzącej z jęczmienia, co 20-30 wiązanie, odchodzi kolejna nitka. Amylopektyny to około 70-90% masy skrobi. W przypadku słodu jęczmiennego to około 80%. Tak wygląda wycinek z takiej potężnej sieci amylopektyny: Wygląda to tak, że raz na jakiś czas dołącza się jedna nitka amylozy. I tak dalej i tak dalej. Jak pójdziemy po jednej z nitek, aż do samego końca, to widok się trochę zmieni. Będzie wyglądał tak: Końcówki zaczną się skręcać. Czasem w podwójną spiralę, a czasem pojedynczą. Zjawisko skręcania występuje wtedy jeśli nitka jest odpowiednio długa. Skręcenia są dość rzadkie w przypadku wewnętrznej części amylopektyny. Zarówno amyloza jak i amylopektyny przeplatają się ze sobą formując coś w rodzaju kłaczków. Poniżej przyda się wiedza na temat działania enzymów scukrzających. W razie problemów zapoznaj się z tym artykułem. Wiele Ci wyjaśni. Jodyna jest łatwo dostępna w aptece. Możesz ją kupić jako środek do odkażania ran lub płyn Lugola. Oba środki nadadzą się do celów piwowarstwa. Jodyna do odkażania jest dość ciemna, więc jeżeli masz wybór lepiej kupić płyn Lugola. Będzie lepiej widać, zwłaszcza w przypadku ciemniejszych piw. Jod nie jest rozpuszczalny w wodzie, aby go rozpuścić używa się jodku potasu. Jod reaguje z anionem jodkowym, tworząc anion trójjodkowy, który jest rozpuszczalny w wodzie. Ważne: jodynę należy przechowywać w ciemnym miejscu. Jod ma taką właściwość, że jak trafi na skręconą amylozę lub skręconą końcówkę amylopektyny, to potrafi wniknąć do środka i ułożyć się w rządku. Zgodnie z [1] może tak połączyć się do 7 cząsteczek, ale najczęściej jest to mniejsza liczba. Potem następuje przerwa i kolejne cząsteczki jodu. Jeżeli na taką strukturę padnie światło, czyli będą bombardować je fotony, to okazuje się, że barwa zmienia się na ciemno niebieską a nawet granatową. Im więcej jodu wniknie do skręconej amylozy, tym kolor staje się ciemniejszy. Dzieje się tak na skutek pochłaniania fotonów (światła) przez taki kompleks. Połączenia mostkowe w amylopektynie, są rzadko skręcone. W takiej strukturze, jodu będzie o wiele mniej. Dlatego amylopektyna barwi się jaśniej, kolor jest raczej wpadający w czerwień. Dodam jeszcze kolejny składnik, czyli enzymy. Załóżmy, że robisz przerwę w temperaturze około 61°C, jest to również dolna granica kleikowania słodu jęczmiennego. Enzym Alfa-amylazy, jeżeli działa, to bardzo słabo. Za to Beta-amylaza ma się świetnie. Rozłoży sporą część amylozy i zewnętrzne części amylopektyny. Dalej Beta-amylaza zatrzyma się, bo nie umie poradzić sobie z rozgałęzieniami. Czyli zostaje dużo skrobi, nie ma skręconych amylaz, jod nie ma gdzie się schować. Przy użyciu płynu Lugola zapewne zauważysz, że jeszcze do końca się nie zatarło. Ale w przypadku jodyny do odkażania, która jest ciemna, możesz się pomylić. Jest jasną sprawą, że nikt tak nie zaciera. Temperatura przerw scukrzających jest wyższa, by trafiać w optimum. Wtedy najczęściej działają zarówno Alfa jak i Beta-amylaza. Skrobia się rozkłada. Próba jodowa wyszła negatywna. Ale czy enzymy skończyły już pracę? Już pewnie się domyślasz, że nie. Jeżeli będziemy mieli dużo krótkich łańcuchów cukru, albo dekstryn z rozgałęzieniami, które mają tylko kilka cząsteczek glukozy, to jodyna nie będzie w stanie się tam utrzymać. Również im krótsze rzędy ułożonej jodyny w spirali amylozy, tym kolor jest jaśniejszy. W cukrach o długości 5-6 cząsteczek, jodyna nie jest w stanie się utrzymać. Próba jodowa wychodzi negatywna a nadal jest dużo krótkich łańcuchów cukrów, na których enzymy będą jeszcze długo działały. Jeżeli przerwiesz zacieranie zaraz po próbie jodowej, to skończysz ze słabo fermentujacą brzeczką, bo drożdże nie są w stanie strawić tak długich łańcuchów cukrów jakie pozostały. Za to bakterie owszem tak. Ryzyko infekcji wówczas wzrasta. Dodam kolejny puzel. Enzymy oraz skleikowana skrobia w trakcie zacierania są wypłukiwane i rozpuszczane w wodzie. Tak powstaje zupa, która będzie brzeczką. Tam zachodzi ogrom pracy enzymów. Alfa-amylaza tnie losowo długie odcinki amylopektyny i amylozy. Beta-amylaza odcina maltozę. Ilość enzymów jest stała i jest ich tyle ile było w słodzie. Część jest niszczona, denaturuje, np.: jak ucieknie Ci temperatura, albo dostaną za dużo ciepła od palnika czy grzałki. Możesz założyć, że ich ilość bardzo powoli spada w czasie zacierania. Za to ilość pracy wzrasta. Pokażę to na przykładzie. Długi polimer amylozy ma 2 tysiące cząsteczek, jest to linia ‘0’ Jedną amylozę może atakować na raz wiele enzymów Alfa-amylazy, ale tylko jeden enzym Beta-Amylazy. Załóżmy że linia 1 była rozcięta tylko przez jeden enzym, gdzieś około połowy. Tak powstały dwa nowe łańcuchy. Jest teraz praca dla dwóch kolejnych enzymów Beta-amylazy. W kolejnym kroku enzymy alfa-amylazy ponownie rozcieły poprzednio powstałe łańcuchy. Co powoduje, że kolejne 4 wolne enzymy Beta-amylazy mogą zacząć rozkładać długi polimer na maltozę. I tak dalej i tak dalej, ilość krótkich amylaz do pewnego czasu wzrasta wykładniczo, potem proces zwalnia, z powodu kończącej się skrobi. Alfa-amylaza jest bardzo wydajna, Beta-amylaza dostaje potężne ilości krótkich łańcuchów, z których powstanie maltoza. Owszem enzymów są duże ilości, ale po pewnym czasie o wiele więcej będzie krótkich polimerów, na których można pracować, a nie ma jeszcze kim, trzeba cierpliwie czekać. Enzymy są niesamowicie szybkie, ale jest taka ilość pracy, że mimo dużej prędkości, potrzeba im czasu by całkowicie scukrzyć zacier. Pamiętaj też, że enzymy nie mają nóg. W tym małym świecie liczą się siły przyciągania i prawdopodobieństwo i Pan Boltzmann. Nawet jak enzym jest wolny, to musi trafić na polimer i to z odpowiedniego końca w przypadku Beta-amylazy. Jako piwowar, możesz pomóc enzymom. Raz na jakiś czas powoli mieszając zacier. Możesz też zamontować mieszadło i zacierać na wolnych obrotach przez cały czas. Proces zajdzie trochę szybciej. Pomimo tego, że próba jodowa, po tych 15 minutach już jest negatywna, to nadal w zacierze są potężne ilości krótkich cukrów, które jeszcze powinny być przerobione przez enzymy. To dlatego warto poczekać jeszcze godzinę, jest to dobra wypadkowa. Proszę zerknij w wolnej chwili do artykułu ‘Beer-busters! Zacieranie z dwoma przerwami – czy i kiedy warto?’. Jest to opis eksperymentu, który przeprowadzał Undeath wraz z kolegami. Zwróć uwagę o ile jeszcze wzrósł ekstrakt, po stwierdzeniu negatywnej próby jodowej. Wynik eksperymentu pokazuje, że warto czekać. W przypadku mocnych piw, gdzie proporcja zasypu słodu do wody wynosi około 1:2 amylazom jest trochę trudniej. W powstającej brzeczce robi szybko się tłoczno i rozpuszczalność spada. Do tego ciecz jest gęsta. Gęsty zacier powoduje mniejsze ruchy wewnątrz i enzymy trudniej trafiają na polimery glukozy, rozkład jest wolniejszy. Dlatego czas zacierania “mocarzy” często się wydłuża. Kilka godzin nikogo nie powinno dziwić. Czy warto robić próbę jodową? Wg mnie próba jodowa jest warta przeprowadzenia przynajmniej w dwóch przypadkach. Pierwszy przypadek, gdy dopiero zaczynasz przygodę. Warto ją robić w celach edukacyjnych. Co 5 minut przez pierwsze 20 minut zacierania, najlepiej na różnych stylach. Potem już co 10 minut do końca czasu zacierania. Pamiętaj tylko, aby odbierać rzadki płyn, bez drobin słodu. Najłatwiej zrobić to sitkiem kuchennym i złapać kilkanaście kropli do łyżki i przelać na biały talerzyk. Obserwacja pokaże Ci jak szybko działają enzymy. Również pozwoli złapać Ci przypadek, że totalnie coś idzie nie tak i test jodowy ciągle wychodzi pozytywny. Wtedy sprawdź czy nie uciekła Ci temperatura, czy twój termometr jest sprawny, może zalało Ci sondę. Prawidłowo zacierane piwo z dobrze dobranym zasypem koniec końców musi wykazać negatywną próbę. Drugi przypadek, to użycie dużych ilości składnika niesłodowanego. Składniki niesłodowane najczęściej nie mają enzymów scukrzających. W takim przypadku na początku upewnij się, że masz minimalną siłę diastatyczną, przynajmniej 30 Linterów, chociaż lepiej około 50. W tym celu warto wybrać słody silnie diastatycznie, jak: jasny pilzneński, jasny pszeniczny, w skrajnych przypadkach można sięgnąć po jasne słody z jęczmienia sześciorzędowego czy nawet słód diastatyczny. Takie dodatki niesłodowane jak: dynia, gryka, pszenica, żyto, mają dużo beta-glukanów. Zacier staje się bardzo gęsty, nawet lekko kisielowaty. Enzymy mają bardzo trudne środowisko pracy. Mimo dobrej siły diastatycznej, będą dłużej działały. Dlatego próba jodowa jest jak najbardziej na miejscu. Będziesz wiedział, jak długo jeszcze poczekać. Sam stosuję zasadę, że minimalny czas zacierania jest trzy razy dłuższy od czasu wykazania negatywnej próby, ale nie krócej jak godzina. Czasem witbier zacierał mi się ponad dwie godziny. Ponownie się trochę rozpisałem, także nie przynudzam już dłużej. Z tak prostej rzeczy jak próba jodowa wyszło małe wypracowanie. Jednakże przemyciłem kilka informacji co dzieje się w zacierze i jak to gra z próbą jodową. Teraz wiesz, że warto poczekać. Może przeczytasz podlinkowany w treści artykuł o sile diastatycznej i skusisz się na witbiera z 70% zasypem pszenicy niesłodowanej. Nie zapomnij tylko jej skleikować. Dziękuję! Głównym źródłem, z którego korzystałem, to dokument: [1] The Structure of the Blue StarchIodine Complex. Zerkałem również do Malt : A Practical Guide from Field to Brewhouse oraz Principles of Brewing Science : A Study of Serious Brewing.- 6 odpowiedzi
-
Witam Wszystkich. Wraca do mnie jak boomerang tematyka piwa bezglutenowego ze względu na to, że w najbliższej rodzinie mam osobę chorą na celiakie. Na rynku pojawiło się wiele piw bezglutenowych, jednak chciałabym takie piwo uwarzyć osobiście. A teraz sedno sprawy - czy ktoś z was, posiada albo wie gdzie można kupić enzymy proteolitycze rozkładające gluten? A może to jakiś składnik wymagający jakiś specjalnych licencji na zakup? Starałem się to gdzieś znaleźć ale jedyne co znalazłem to suplementy diety:)
- 6 odpowiedzi
-
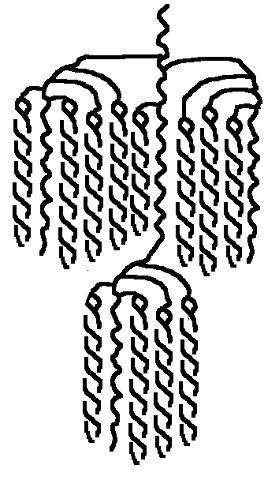
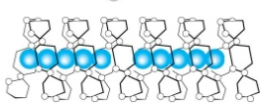
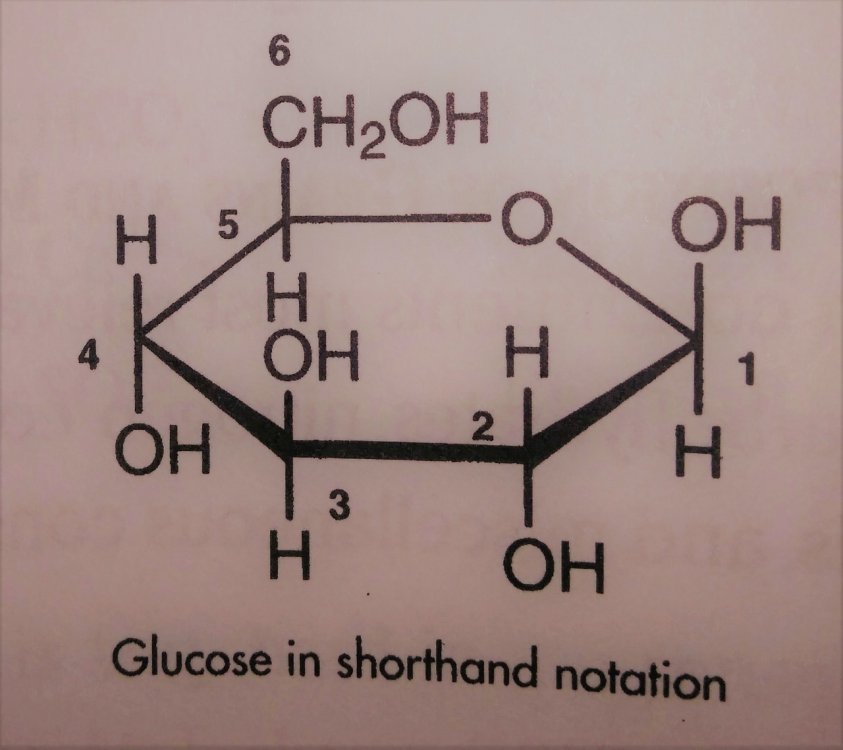
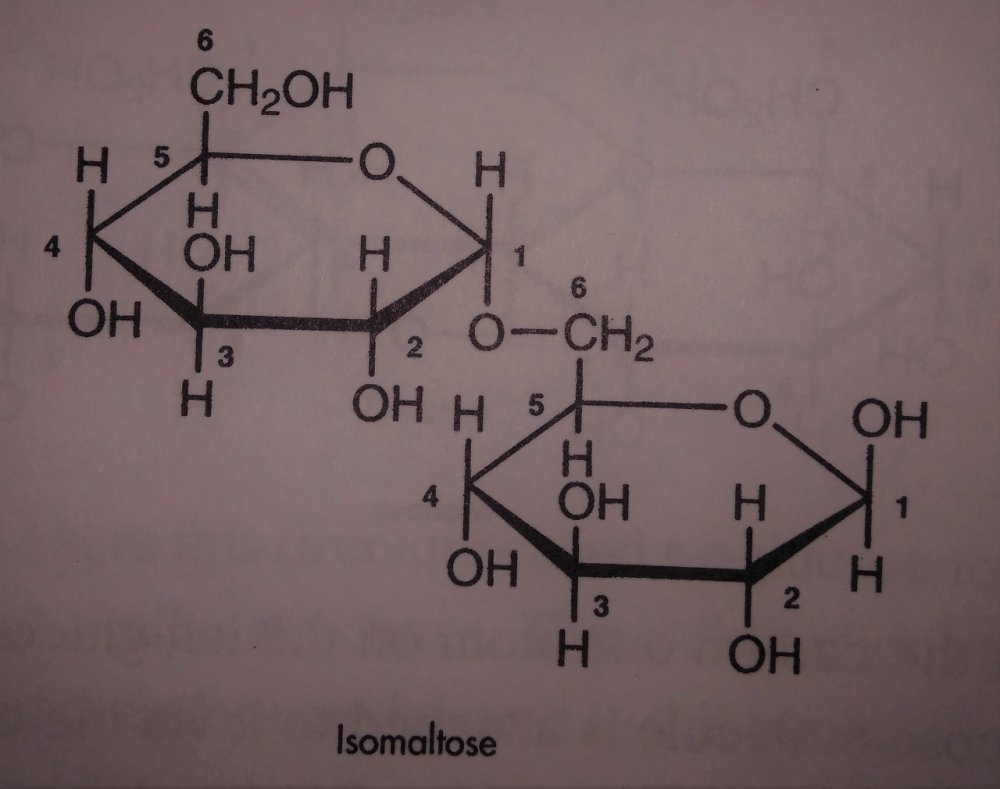
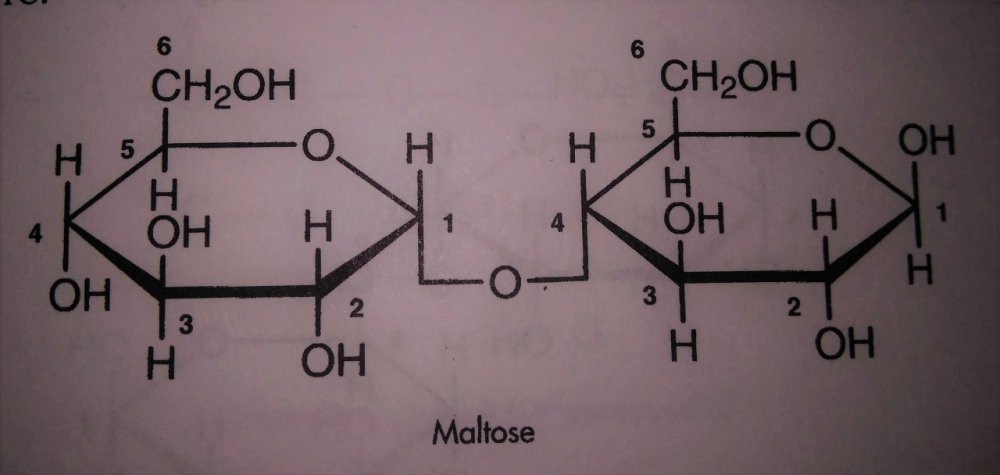
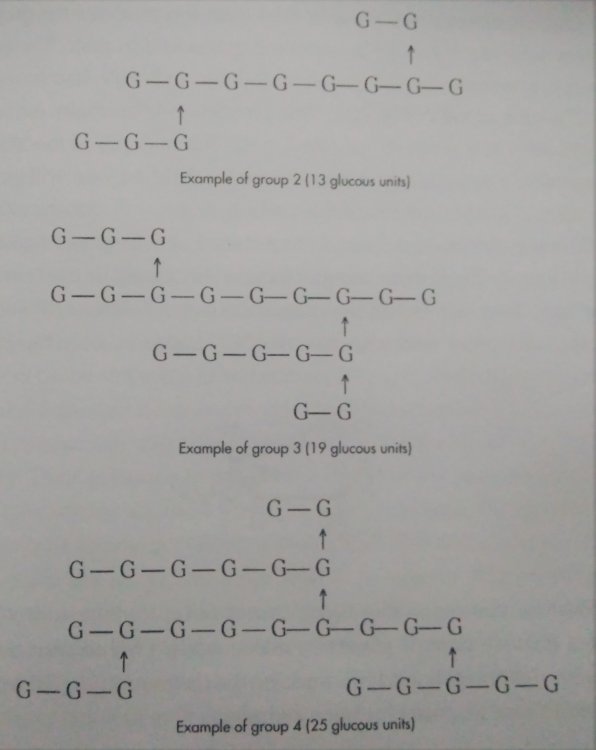
Skrobia i jej konwersja do cukrów prostych a przynajmniej prostszych. Zastanowiło mnie to pytanie kolegi @Fenris. I zrozumiałem, że nie rozumiem jak te enzymy tak naprawdę działają Nie dało mi to spać i sprawdziłem w tych źródłach. [1] Principles of Brewing Science : A Study of Serious Brewing [2] Skojarzylem, że moja ulubiona strona z temperaturami kleikowania jest w zasadzie o konwersji skrobi a kleikowanie to tylko jeden z etapów. [3] Nie mogło się obejść bez super artykułu o biochemii piwa Na sam koniec warto obejrzeć ten film, w którym jest to wyjaśnione w kilka minut. Wnioski spisuję poniżej, może komuś się przyda. W brzeczce mamy wiele cukrów, które w zasadzie prawie zawsze składają się z cząsteczek glukozy. Glukoza wygląda tak (zaczerpnięte z [1]): Te numerki oznaczają ponumerowane atomy węgla. Jako, że związki organiczne to związki węgla to literki C najczęściej się nie pisze. Na każdym z tych ‘skrzyżowań’ przy numerku jest atom węgla. Glukoza ma taką właściwość, że jest w stanie łączyć się w bardziej złożone cząsteczki. Jeżeli dołączymy do powyższej cząsteczki drugą. Połączymy ze sobą węgiel 1 z węglem 4 za pomocą tlenu to będziemy mieli maltozę. Dygresja pisząc wiązania mam na myśli wiązania alfa 'α'. Inne z punktu widzenia piwowara domowego są mniej ciekawe, bo tworza inne związki i wymagają innych enzymów do rozłożenia, których w brzeczce nie ma. Przykładem takiego innego cukru jest celuloza która zamiast wiązań alfa ma wiązania beta. Dodając kolejną cząsteczkę do szeregu (ponownie 1,4) będziemy mieli trójcukier nazwany maltotriozą. Dodając kolejne cząsteczki glukozy wiązaniem 1,4, i trochę upraszczając, zbuduje się długa nitka zwana amylozą. Zobaczcie, że dołączana jest cząsteczka glukozy zawsze po prawej stronie. Lewy koniec takiej nitki nazywa się nieredukujący prawy do którego dołączyliśmy cząsteczki to koniec redukujący. Będzie to ważna za chwilę. Amylozy, mogą się łączyć ze sobą i ich natura jest taka, że łączą się ze sobą za pomocą tlenu co 20-30 cząsteczek glukozy wiązaniem 1,6. To stanowi około 4% połączeń. Wiązanie takie wygląda tak (zaczerpnięte z [1]): Tylko te dwa rodzaje wiązań potrafią budować bardzo złożone struktury - amylopektyny. Przykładowo (zaczerpnięte z [1]): G - to cząsteczka glukozy. Myślniki między nimi to wiązania 1,4, strzałki w górę to wiązania 1,6. W rzeczywistości połączonych cząsteczek glukozy są ogromne ilości. Amylopektyny i Amyloza to w naszym rozumieniu skrobia. Po lewej stronie każdej z linii to koniec nieredukujący po prawej redukujący (tam może się doczepiać kolejna cząsteczka glukozy). Wkraczają nasi czterej bohaterowie, bardzo znani i lubiani: α-amylaza, β-amylaza, i mniej znani, teochę w cieniu, dekstrynaza graniczna oraz α-glukozydaza. Do tej pory myślałem, że α-amylaza jest w stanie rozerwać wiązanie 1,6. Oczywiście było to uproszczenie wyczytane w którejś z książek. Nie jest to jednak prawda. Wiązanie 1,6 jest w stanie rozciąć enzym dekstrynazy granicznej, stąd jej nazwa. Dekstrynaza graniczna jest niestabilna w temperaturach zacierania i wg artykułu [2] oraz [3]. W temperaturze powyżej 62.5°C staje sie coraz mniej znacząca. Właśnie dlatego mamy sporo dekstryn w piwie, ale to za chwilę. Zacierając w niskich temperaturach sporo tych wiązań zostanie rozbitych i w efekcie będzie bardziej fermentowalana brzeczka. Ale też mocno ją wytrawi za sprawą alkoholu. Dekstryny powodują, że piwo jest bardziej pełne w smaku. Dygresja, w How To Brew, Palmer określa piwa z dużą ilością dekstryn jako 'fart beers' Enzym α-glukozydaza (ang. maltase) ma optimum w zakresie 30°C - 40°C, powyżej 45°C ulega denaturacji (zniszczeniu) i nie jest już zdolny do pracy. A to co potrafi robić, to odcinać cząsteczki glukozy z końców nieredukujących. I kolejny problem. W takiej temperaturze nie zaszło jeszcze kleikowanie, skrobia nie została uwolniona. Ten enzym niewiele ma do roboty jak wrzuciłeś słód do wody o temperaturze 40°C. Chyba, że podzielimy zasyp, powiedzmy na pół. Część zatrzemy (bo najpierw się skleikuje) ponownie obniżymy temperaturę do 40 stopni i dodamy drugą część zasypu. Tak robią pszenicę w Weihenstephan (polecam spróbować na szczepie WY3068 Weihenstephan Weizen). Dodatkowa glukoza ma znaczny udział w produkcji estrów. Będzie zauważalnie więcej banana (dzięki @Undeath za materiały o tym) Wróćmy do znanych bohaterów. β-amylaza, potrafi rozbijać tylko wiązania 1,4 i odcinać dwie połączone cząsteczki glukozy czyli maltozę. Dodatkowo ma inne ograniczenia. Odcina tylko od strony końca nieredukującego oraz jak jest blisko wiązania 1,6 to nie potrafi się tam ‘wcisnąć’ i zostawia w efekcie kilka cząsteczek glukozy. Nie znalazłem ile dokładnie, na rysunkach w artykułach widać, że są to 2 cząsteczki glukozy przed wiązaniem 1,6, nie musi to być prawda. Zatem wydawałoby się, że szybko skończy i się zablokuje. Bo obedrze skrobię z wszystkich nieredukujących końców, dotrze do wiązań 1,6 i dalej stoi. Otóż nie, bo wchodzi α-amylaza, cała na biało. Taki berserker. Tnie wiązania 1,4 (i tylko te) na ślepo, losowo. To ona robi końce nieredukujące dla β-amylazy. Jest jeszcze jedna ważna sprawa. Enzym α-amylazy nie potrafi działać bez wapnia. Brzeczka mająca poniżej 50 mg/l wapnia nie zrobi dobrego piwa, Wapń jest również zawarty w słodzie, jasne słody mają go około 90mg/kg. Zalecane jest około 200 mg/l [1]. Z wapniem też nie ma co przesadzać, bo zrobi kolejne problemy, jak mętne piwo po nagazowaniu. Zauważyłeś, że jak podnosisz temperaturę to zacier staje się bardziej płynny po jakimś czasie. To właśnie α-amylaza rozcinając długie łańcuchy na krótsze i powoduje upłynnienie zacieru. Kolejne ograniczenie α-amylazy to to, że nie potrafi odcinać pojedynczych cząsteczek glukozy, oraz kończy działanie przynajmniej jedną cząsteczkę przed wiązaniem α-1,6 Tak wygląda tabla optymalnej pracy poszczególnych enzymów: Enzym Temperatura °C pH α-glukozydaza 30 - 40 ~6 dekstrynaza graniczna 60-62.5 5,5 β-amylaza 60-65 5.4-5.6 α-amylaza 72-75 5.6-5.8 We wszystkich przypadkach wypadkowe pH wynosi około 5.5. Wypadkową temperaturą dla β-amylazy i α-amylazy jest zakres od 65 - 68°C. Dlaczego tak?Ponieważ w temperaturze 69°C β-amylaza stanie się nieaktywna po kilku-kilkunastu minutach [2]. Pozwoliłem sobie pożyczyć obrazek z [2], aby to wszystko zwizualizować. Podsumowując. Niebieskie strzałki to β-amylaza, odcina maltozę od końca nieredukującego i nie jest w stanie podejść bliżej jak na dwie cząsteczki glukozy od wiązania 1,6. Enzym czerwony to α-amylaza tnie losowo. To odetnie maltozę, to maltotriozę, to jakiś dłuższy łańcuch. Po odcięciu jest duża szansa, że będzie nowy koniec nieredukujący dla β-amylazy, w efekcie szybciej się będzie zacierało. Dekstrynaza graniczna (zielona) w wyższych temperaturach ma małe szanse na działania i w efekcie zostawi większość wiązań 1,6. To będą bardziej złożone i niefermentowalne cukry, dekstryny. Również jak nie pozwolimy β-amylazie zbyt długo działać i podniesiemy temperaturę powyżej tych 70°C w efekcie szybko wyłączając ją. Następnie pozwolimy trochę podziałać α-amylazie, powiedzmy w 72°C, to otrzymamy więcej długich cukrów jak maltotrioza. Oraz jeszcze dłuższych, które są zbyt skomplikowane dla drożdży by je zjadły. Oczywiście jak będzie działała odpowiednio długo, to uszczupli trochę wapnia (bo potrzebuje go do działania) i jest szansa, że wyprodukuje sporo więcej cukrów fermentowalnych. Tutaj już wchodzi warsztat i wyczucie piwowara. Dlatego też piwa zacierana w 74°C mają negatywną próbę jodową, są zatarte z punktu widzenia piwowara, chociaż mają mniej fermentowalnych cukrów. Jeszcze ciekawostka z [1]. Piwa które mają przerwę w 70-74 stopniach mają najczęściej lepszą pianę. Dzieje się tak na skórek łączenia krótszych białek z niektórymi dekstrynami. Optimum przypada na 72 stopnie. Jest to częsta temperatura w schematach zacierania. Została w zasadzie znaleziona empirycznie jako wynik obserwacji. Dopiero niedawno nauka znalazła potwierdzenie obserwacji. Na sam koniec mash-out, lub jak kto woli wygrzew. Dlaczego w 78°C? Dlatego, że gorąca woda może wypłukać jeszcze trochę skrobi, która się schowała gdzieś głębiej, powiedzmy w grubszych cząsteczkach śruty. W tej temperaturze α-amylaza jest jeszcze trochę aktywna. Zatem jest duża szansa, że zdąży tę skrobię resztkową rozłożyć. Skrobia jest niekorzystna w piwie. Powoduje jego zmętnienie i stanowi pożywkę dla bakterii. W długiej perspektywie bakterie mogą zacząć żyć i psuć piwo. To tyle, mam nadzieję, że się podobało. Zachęcam do przeczytania przynajmniej artykułów, które wymieniłem na początku. Tam jest to wyjaśnione bardziej szczegółowo. Jeżeli zauważyłeś błąd daj mi znać. Mam nadzieję, że nie pokręciłem pojęć i definicji podczas tłumaczeń. Nie jestem zawodowo związany z chemią/biochemią i wiele z tych pojęć było dla mnie nowe.
- 6 odpowiedzi
-
Witam serdecznie wszystkich, Przygotowuję się do zrobienia piwka dla znajomego, który jest cukrzykiem. Czy ktoś wie, gdzie można dostać amyloglukozydazę w Polsce? AMG 300 L jest dostępne w wielu sklepach dla browarników, ale zagranicą. Pozdrowienia
- 6 odpowiedzi
-
- enzymy
- amyloglukozydaza
-
(i 1 więcej)
Oznaczone tagami: