Znajdź zawartość
Wyświetlanie wyników dla tagów 'rezydualna alkaliczność' .
-
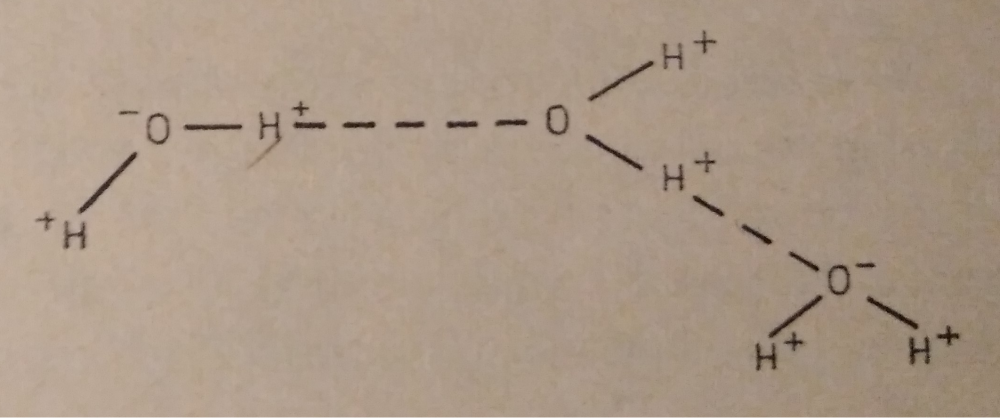
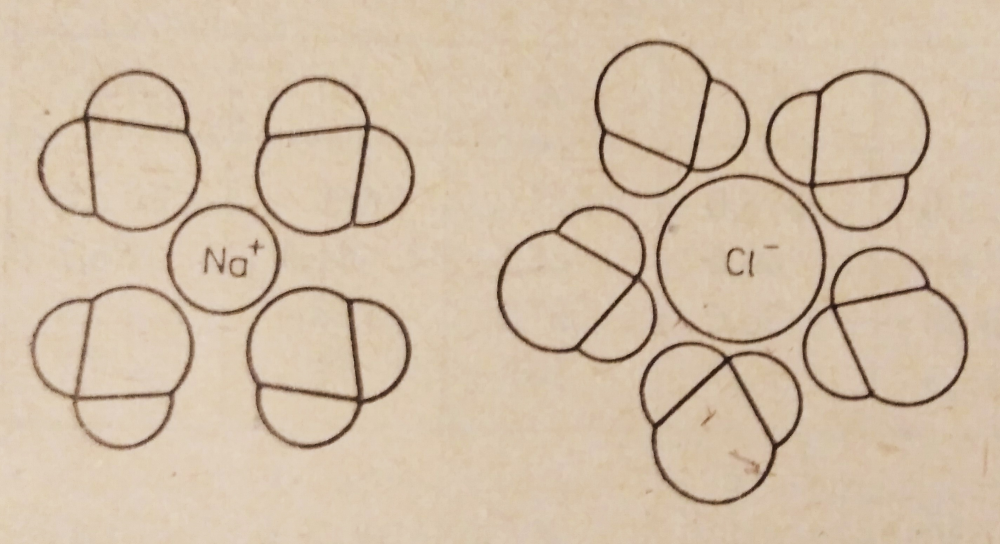
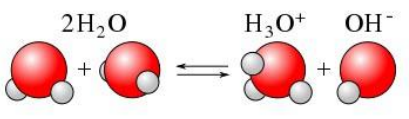
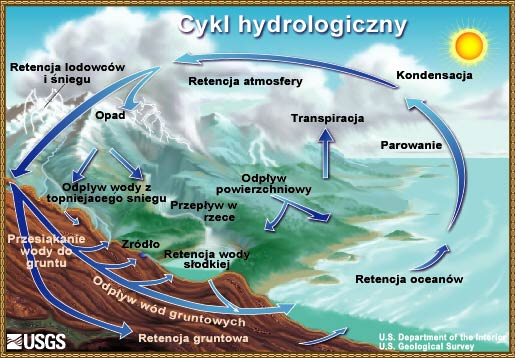
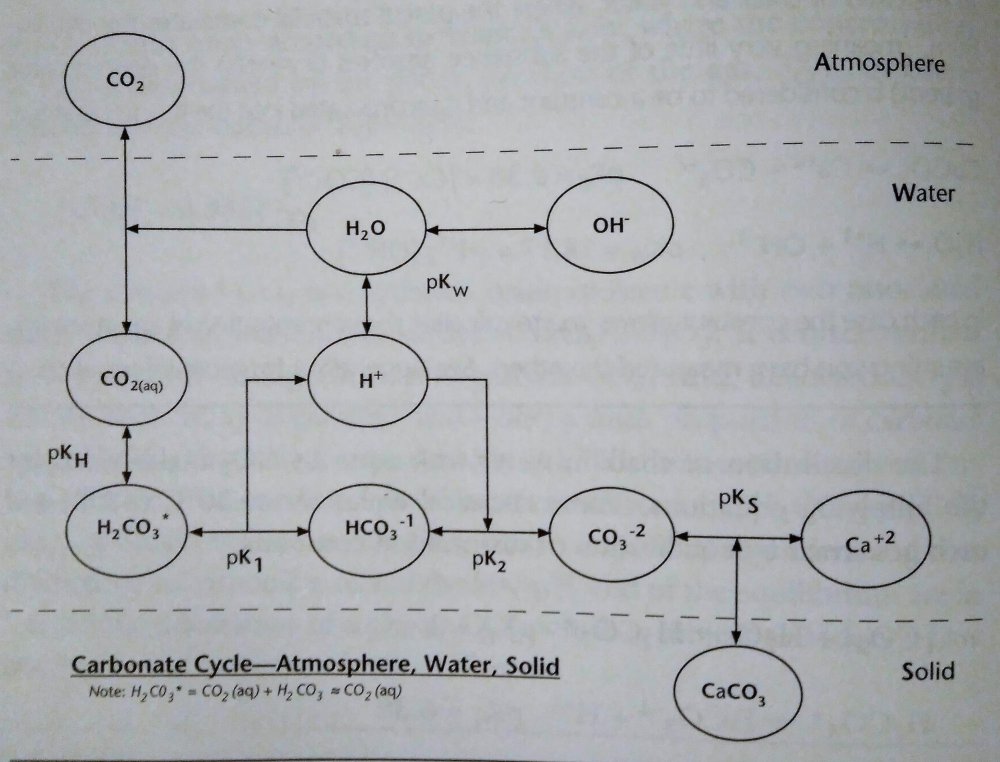
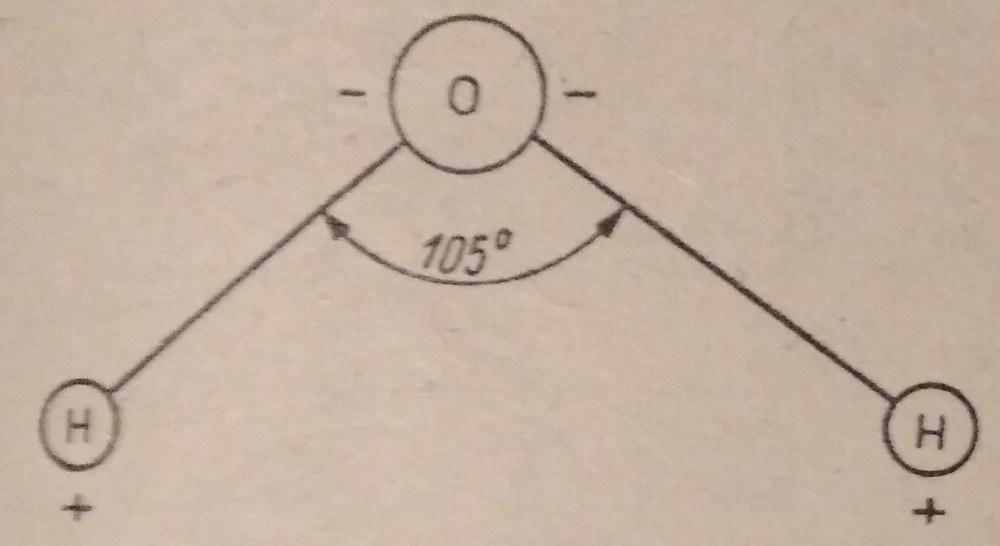
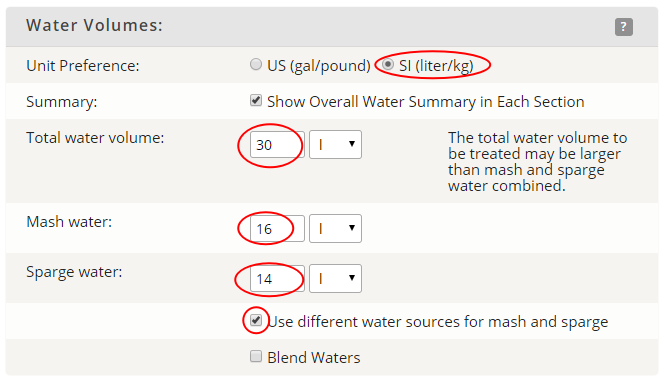
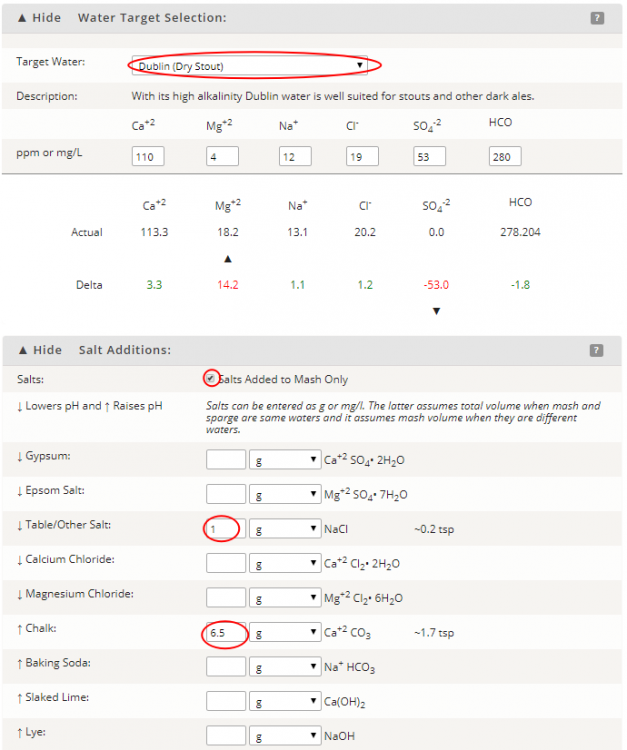
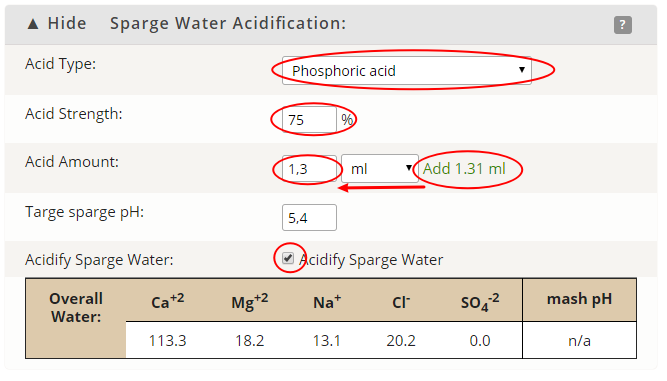
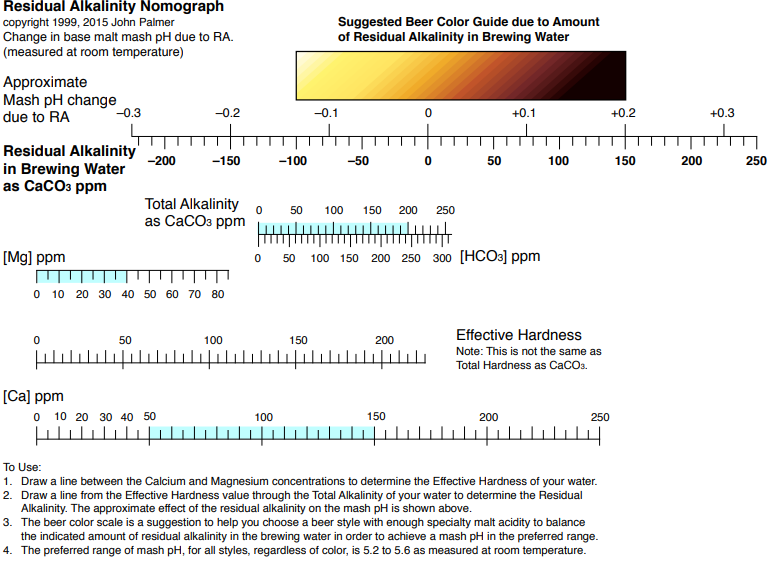
Wpływ tlenku wodoru na piwo czyli o wodzie w browarze domowym, bez lania wody Tlenek wodoru, również zwany oksydanem, to nic innego jak woda. H2O jest to najczęściej spotykana cząsteczka wody o niezwykle ciekawych właściwościach. Jakby nie patrzeć, woda jest głównym składnikiem piwa. Mówiąc o wodzie będę miał na myśli wszystko co jest w niej rozpuszczone i zawieszone. Woda jest przeceniana przez początkujących adeptów piwowarstwa domowego. Jest również niedoceniana przez wielu zaawansowanych piwowarów. W literaturze spotkasz się lub spotkałeś z opinią, że pozwala robić piwa świetne pod warunkiem, że nauczyłeś się robić piwa dobre. Woda w piwowarstwie używana jest na każdym etapie produkcji. Zauważ, że myjemy cały sprzęt. Niemal zawsze używamy jej jako rozpuszczalnika środków dezynfekujących. Dzięki doskonałym właściwościom cieplnym jest niezastąpiona podczas chłodzenia oraz podgrzewania. Nawet w zacierze proporcja wody do słodu ma znaczenie. Zacier najczęściej trzeba wysłodzić, oczywiście wodą. To woda jest w końcu głównym składnikiem piwa. Mimo tego, dość mało o niej wiemy. W tym artykule chcę zmierzyć się z tematem wody w kontekście naszego hobby. Z góry ostrzegam, że będzie trochę wzorów. Jeżeli jeszcze się nie wystraszyłeś to zapraszam. Dygresja: Zanim zaczniesz modyfikować wodę na potrzeby swoich warek to proszę o chwilę refleksji. Zadaj sobie pytanie: czy opanowałeś czystość? (w kontekście braku infekcji). Drugie pytanie: czy masz warunki i jesteś w stanie przeprowadzić poprawnie fermentację? Jeżeli wahałeś się odpowiedzieć twierdząco na którekolwiek z pytań, to nie ma sensu dostosowywać wody. Woda ma wpływ na smak, ale na tyle subtelny, że każdy błąd fermentacji spowoduje, że nie odczujesz różnicy. Błędy fermentacji je przykryją. Natura i wodociągi tak chciały, że woda z kranu najczęściej się nadaje do warzenia i zrobi dobre piwo. Napisałem najczęściej, bo czasem jest tak, że w piwie goryczka ściąga, na podniebieniu występuje dziwna szorstkość, a słody nie oddają w pełni swojego charakteru. Temu może być winien profil wody. Zapraszam i zachęcam do dalszego czytania, mam nadzieję, że na wodę spojrzysz jako składnik piwa, który coś znaczy. Artykuł opieram na poniższych źródłach: “Water”: A Comprehensive Guide for Brewers, John Palmer, Colin Kaminski, Brewers Publications 2013, ISBN 09-373-8199-3. Chyba jedyne, bardzo dobre, opracowanie na temat wody stricte w kontekście piwowarstwa. Aby zrozumieć niektóre koncepcje w niej przedstawione musiałem posiłkować się pozycjami i artykułami wymienionymi poniżej. “Chemia wody”, Jan R. Dojlido, Arkady 1987, ISBN 83-213-3359-1. Stąd będą pochodzić wzory, budowa cząsteczki wody oraz jej właściwości. Kompendium wiedzy o chemii wody. “How to Brew: Everything you Need to Know to Brew Beer Right the First Time”, John Palmer,30 maja 2006, ISBN 0937381888, pozycji chyba nie trzeba przedstawiać. Część, z której korzystałem można przeczytać on-line tutaj. “Opracowania tematów z chemii”, Praca zbiorowa pod redakcją Witolda Mizerskiego. Grupa Wydawnicza Adamantan s.c. 2017, ISBN 978-83-7350-431-8. Posiłkowałem się rozdziałem o obiegu wody na naszej planecie, wzbogacając go o dodatkowe informacje z [2] oraz [1]. Stanowi też źródło definicji części pojęć chemicznych. Książka mi bardzo pomogła zrozumieć wiele zagadnień chemicznych. https://wiki.piwo.org, kawał dobrej roboty jeżeli chodzi o dostosowywanie składu wody. W artykule również będę poruszał ten temat, ale nie tak obszernie. Nie ma sensu się powtarzać. Prelekcja Johna Palmera ‘Residual Alkanity & Brewing Water’. Jest to w zasadzie śmietanka wzięta z [1]. Artykuł: Understanding Residual Alkalinity & pH pochodzący z Brew Your Own. Pokrywa się z wiki [5], dodatkowo omawia zależność pomiędzy kolorem piwa a alkalicznością. Artykuł jest opublikowany w ramach wolnego dostępu. Nie jestem związany z chemią i temat, z którym się mierzę był mi bardzo trudny. Na szczęście Kantor oraz Tibek wsparli mnie jako recenzenci techniczni. Dodatkowe wsparcie merytoryczne oraz stylistyczne otrzymałem również od żony, jako pierwsze przebiła się przez artykuł wprowadzając niezliczone poprawki. Ostateczny kształt artykuł uzyskał po wprowadzeniu poprawek i uwag otrzymanych od Alert, Oskaliber, Pan Łyżwa i Undeath. Nie sposób streścić całą chemię wody na kilku stronach, dlatego musiałem zastosować wiele uproszczeń. Recenzenci spisali się na medal, poprawiali mnie i kierowali ponownie na tory jeżeli gdzieś się myliłem. Po prostu właściwi ludzie na właściwych stanowiskach i to we właściwym czasie! Przeczytanie artykułu zajmie Ci wieczór a może nawet cztery. Możesz zasnąć, bo zdarza mi się troszeczkę przynudzać. Zaczynajmy. Przyroda to ‘psotnik’, tak wielki, że trzeba o tym opowiedzieć. Brzmi zagadkowo? Zagadki są po to by je rozwiązywać. 1. Cykl hydrologiczny Cykl hydrologiczny to naukowa nazwa obiegu wody w przyrodzie. Woda na naszej planecie zajmuje większość powierzchni, jest to woda z rozpuszczoną dużą ilością minerałów, mówię oczywiście o wodzie słonej. Woda słodka powstaje w jednym z etapów cyklu hydrologicznego. Początkowo słona woda z mórz i oceanów, ale też lądowa, ogrzewa się i paruje. Słońce dostarcza energii, by proces w ogóle mógł zajść. Parująca woda to nic innego cząsteczki wody w postaci gazowej, myślę że analogia do gigantycznego destylatora jest w tym przypadku na miejscu, ‘psotnik’ się odnalazł. Lotne cząsteczki zostawiły rozpuszczone sole oraz zanieczyszczenia i unoszą się ku górze. Wysoko w atmosferze postać gazowa kondensuje się w wyniku obniżenia temperatury. To zjawisko jest namacalne, to oczywiście chmury. W chmurach woda może przybierać dwa stany skupienia: ciekły w postaci drobinek wody oraz stały jako kryształki lodu. Powierzchnia planety nie ma jednakowego ciśnienia. Różnice ciśnień w różnych obszarach powodują ruch powietrza, czyli wiatr, ten pcha chmury. Część z nich trafi na lądy. Przy odpowiednich warunkach spadnie na ziemię w postaci deszczu lub śniegu, czasem gradu. Po opadzie, woda ponownie paruje powtarzając cykl. Część jednak zdąży wsiąknąć w glebę, zasilić rzeki, jeziora oraz inne cieki wodne. Rzeki z czasem spłyną do morza lub oceanu i ponownie cykl się powtarza. Części wody, jak już wspomniałem, wsiąknie i powiększy zasoby wody podziemnej. W cyklu również dużą rolę odgrywają rośliny i zjawisko transpiracji. Mamy również zmagazynowane duże ilości wody w wiecznie zmarzniętych lodach. Cykl hydrologiczny przedstawia rysunek: W ten sposób mamy wodę nadającą się do picia, nawet jeśli źródłem jest słony ocean czy też obszar wodny o znikomym znaczeniu strategicznym, czyli kałuża. Nasze ujęcia wody pochodzą z wód gruntowych jak rzeki, studni np. oligoceńskich lub głębinowych. Do każdego źródła woda dotarła w nieco inny sposób i pod innymi warunkami. Wody powierzchniowe w krajach rozwiniętych, często są mocno zanieczyszczone przez odpady chemiczne, które wiszą w powietrzu lub osiadają na powierzchni. Podczas opadów woda je rozpuszcza i niesie ze sobą. Oprócz odpadów z atmosfery krople wody rozpuszczą w sobie niewielką ilość dwutlenku węgla. Woda wsiąkając w ziemię rozpuszcza minerały z gleby. Woda, która dociera do głębin przesącza się przez pokłady kredy, gdzie staje się bogatsza w wapń, a dolomity wzbogacają ją również w magnez. Ważną rolę w tym procesie odgrywa dwutlenek węgla i ciśnienie. Zakłady uzdatniania wody nie mają lekko. Zanim woda popłynie z kranu musi być do tego przygotowana. Zanieczyszczenia zostaną z niej usunięte, a mineralizacja utrzymana w normach. Większość pracy w tym temacie wykonują duże stacje uzdatniania wody, małe stacje przydomowe, lub jeszcze mniejsze systemy odwróconej osmozy (RO - reverse osmosis). Masz już pogląd jak to wszystko wygląda. Nie bez przyczyny wymieniłem kilka pierwiastków. W kontekście piwowarstwa będziemy najbardziej zainteresowani kilkoma rozpuszczonymi cząsteczkami/jonami, będzie to dwutlenek węgla CO2, wapń Ca2+ oraz magnez Mg2+. Pominę zanieczyszczenia innymi metalami i związkami - tym zajęły się punkty uzdatniania. Wspomniałem o rozpuszczalności, zacznę od wyjaśnienia tego zjawiska. By to zrobić musimy zejść do nieco mniejszego wymiaru. Opowiem trochę o cząsteczce wody [2]. 2. Właściwości wody Ograniczę się do minimum, jeżeli jesteś bardziej dociekliwy to zapoznaj się z definicją wody, którą oferuje Wikipedia. Wszystkie rysunki zapożyczyłem z [2]. Świetna książka, z racji wieku niektórzy sensorycy piwni powiedzieliby że się ‘utleniła’. Otóż wcale nie, ciągle jest aktualna i świeża. Graficznie cząsteczka wody wygląda tak jak na poniższym rysunku. Tlen tworzy wiązanie z dwoma atomami wodoru. Jest to solidne wiązanie, ponieważ tlen potrzebuje dwóch elektronów, aby na powłoce walencyjnej miał oktet. Atomy wodoru są oddalone od siebie i usytuowane pod kątem blisko 105°. Atom tlenu zyskuje dwa elektrony, które mają ładunek ujemny. Wodór przekazał elektron i ma ładunek dodatni pochodzący od protonu. Przez niesymetryczną budowę cząsteczka H2O zyskuje moment dipolowy. Wypadkowy ładunek jest równy zeru, ale nierównomierne rozłożenie powoduje, że cząsteczka jest polarna (dipolowa). Można powiedzieć, w uproszczeniu, że przy tlenie jest trochę ujemna a przy wodorze trochę dodatnia. To daje wodzie super właściwości. Cząsteczki wody potrafią łączyć się w większe grupy tzw. asocjacje, chaotyczną sieć połączonych ze sobą cząsteczek sięgającą nawet do 100 sztuk [2]. Przerywane linie to połączone kolejne cząsteczki wody. Asocjacje czasem pękają w różnych miejscach pod wpływem sił zewnętrznych. Wtedy mówimy o zjawisku dysocjacji. Czasem wiązanie pęknie tak, że powstają dwa jony. Kation hydroniowy H3O+ oraz anion wodorotlenkowy OH-. Reakcja ta ma zapis: 2H2O ⇔ H3O+ + OH-, jest to dysocjacja. Strzałka skierowana w dwie strony oznacza, że reakcja przebiega w jednocześnie w obie strony. Gdzieś w szklance wody cząsteczki się rozpadają tworząc jony, a w innym miejscu jony łączą się ponownie tworząc wodę. Reakcja ta zachodzi bardzo, bardzo rzadko, ale ma ogromne znaczenie. Wrócę do tego jak będę omawiał pH. Jon, jest to atom lub grupa związanych atomów, która posiada ładunek elektryczny. Jeżeli ładunek jonu jest dodatni, to mówimy o kationie. Wtedy atom oddał jeden lub więcej elektronów i stał się przez to naładowany dodatnio. Jeżeli jest to więcej jak jeden elektron, to liczbę zapisuje się w górnym indeksie ze znakiem ‘+’ dla kationów, analogicznie ‘-’ dla anionów. Przykładem jest kation wapnia Ca2+, lub wodoru H+. Jeżeli atom lub grupa przyjęła elektron, wtedy mówimy o anionach, które mają ładunek ujemny. Przykład to wodorotlenek OH- oraz anion węglanowy CO32-. Dygresja: W rozważaniach, kationami będą metale pochodzące z rozpuszczonych soli, już wymieniony Ca2+, Mg2+ ale też Fe2+. Numer w indeksie górnym to ładunek jonu, w przypadku kationów metalicznych jest równy stopniu utlenienia. Utlenienie to nie jest reakcja związana tylko z tlenem jako pierwiastkiem. Warto zapoznać się z definicją reakcji redoks. W piwie za utlenianie odpowiada nie tylko tlen, ale też szereg procesów w efekcie powodujących jego starzenie w mniej lub bardziej przyjemny sposób. Jak to się dzieje, że woda rozpuszcza? Wsypuję łyżkę soli a ta znika. Cóż, są trzy drogi by woda rozpuściła substancję [2]: zawiesina - cząsteczki o rozmiarze większym jak 0.5µm są zawieszone w wodzie. Z czasem pod wpływem pewnych sił i warunków, jak temperatura i ciśnienie sedymentują (opadają) na dnie. koloid - rozmiar cząsteczki poniżej 0.5µm, ale większy aniżeli 1nm. Ten stan w odpowiednich warunkach może utrzymywać się permanentnie. W piwach kolodiy najczęściej sedymentują po długim okresie czasu. Nawet piwo pszeniczne wyklaruje się w odpowiednio długim czasie. Chłód przyśpieszy ten proces. Czy Twoje piwo to koloid? Możesz to łatwo sprawdzić wykorzystując efekt Tyndalla (en). roztwór - cząsteczki mniejsze od 1 nm. W tym artykule będę mówił o tym typie rozpuszczenia. Dygresja: Zawiesiny i koloidy są czymś naturalnym w piwie domowym. Są spowodowane przez cząsteczki chmielu, białka, pozlepianych tanin z białkami, czasem skrobi. Zawiesiny i koloidy można odfiltrować mechanicznie lub strącając je chemicznie. Teraz wiesz jakim filtrem mechanicznym musisz się posługiwać, by pozbyć się cząstek zawieszonego chmielu. Dlatego w piwowarstwie domowym filtrują ułożone złoża a nie wielkość oczek w filtrze oraz czas filtracji. Wybierając filtrator ważniejszym parametrem będzie jego powierzchnia wymiany. By znacznie ograniczyć ilość zawiesiny/koloidu lepiej użyj szybkiego schłodzenia, z angielskiego zwanego cold crash (CC). Jeżeli jest to za mało skuteczne, to zawsze możesz użyć żelatyny, zolu krzemionkowego, mchu irlandzkiego, isinglasu. Rozpuszczalność najczęściej zależy od temperatury i ciśnienia. Wraz ze wzrostem temperatury rozpuszczalność minerałów/soli rośnie, gazów maleje (są wyjątki od tej reguły). W przypadku gdy ciśnienie wzrasta a temperatura spada wtedy rozpuszczalność gazów jest większa. Sole rozpuszczają się dysocjując. Cząsteczka rozpada się na jony. Następnie woda, dzięki właściwościom polarnym otacza taki jon i utrzymuje go zawieszonego w strukturze. Myślę, że ilustracja powie więcej aniżeli suchy opis. Tak wygląda rozpuszczona cząsteczka soli kuchennej: Sól kuchenna (NaCl) jest jak najbardziej wykorzystywana do modyfikacji wody w piwowarstwie. Przeciwne ładunki się przyciągają, polarność wody gra tu kluczową rolę. Kation sodu Na+ zostaje otoczony przez cząsteczki wody. Jako, że bliżej tlenu znajduje się ładunek ujemny to cząsteczki ‘obrócą’ się tak, aby wzajemnie się przyciągać. W przypadku anionu chloru Cl- bliżej są kationy wodoru H+. Tak właśnie wygląda rozpuszczanie substancji w roztworze. Zauważ też, że do rozpuszczania jednego jonu potrzeba jest kilku cząsteczek wody. Jest to jeden z powodów, dlaczego różne substancje rozpuszczają się w różnym stopniu. Co w przypadku takich cząsteczek jak dwutlenek węgla CO2? Jest to cząsteczka liniowa. Do atomu węgla po przeciwnych stronach dołączone są atomy tlenu (cząsteczka dwutlenku węgla jest tak liniowa, że mogę stworzyć jej rysunek w tekście: O=C=O). Nie wykazuje właściwości polarnych. Nie jest to też jon. W tym przypadku woda również sobie poradzi, w mniejszym stopniu, ale zawsze. Dwutlenek węgla zostanie otoczony przez dwie cząsteczki wody [1], które są w stanie utrzymać go w swojej strukturze. Rozpuszczone cząsteczki, w odróżnieniu od wolnych są często zapisywane w postaci CO2(aq) lub CO2*. Szereg reakcji chemicznych zachodzących w wodzie jak: utlenienie, hydroliza oraz kwaśna hydroliza [2] umożliwią lub przyspiesza rozpuszczanie. W przypadku hydrolizy woda jest zarówno rozpuszczalnikiem jak i substratem (bierze udział w reakcji). Przykładowo wapno, które jest wypłukiwane z pokładów kredy (CaCO3). Reakcja ma następujący przebieg: CaCO3 + 2H2O ⇔ Ca(OH)2(aq) + H2(CO3)(aq). Czyli dwie cząsteczki wody weszły w reakcję z kredą, wapno zostało uwodnione, powstało wapno gaszone i kwas węglowy. Na dodatek taką chemię pijesz pod ładną nazwą minerałów. Masz już pojęcie jak sole mineralne oraz gazy rozpuszczają się w wodzie. Ilość oraz rodzaj tych substancji najczęściej odnajdziesz w raporcie wody. W piwowarstwie najważniejszymi elementami raportu są: alkaliczność, wartość pH oraz zawartość wapnia i magnezu. Wapń i magnez występuje głównie w postaci węglanów, siarczanów i chlorków. To wszystko trzeba wyjaśnić i usystematyzować. 3. Odczyn i skala pH Wartość pH odgrywa jedną z kluczowych ról podczas zacierania. Zanim podam definicję, chcę powiedzieć czym jest ten współczynnik w ujęciu chemicznym oraz rolę w procesie warzenia. Jeżeli jesteś niecierpliwy, przeskocz kilka akapitów. Wracam do wzoru, który przedstawiłem na początku. Pozwolisz, że przypomnę. W czystej wodzie nieustannie zachodzi reakcja samorzutnego rozpadu cząsteczek. W wyniku tego powstają jony hydroniowe H3O+ oraz wodorotlenkowe OH-. Reakcja jest dwukierunkowa, czyli jony łączą się ze sobą tworząc ponownie cząsteczkę wody. Dzieje się to ciągle i na pewnym poziomie. W szklance herbaty czy też piwa w jednym miejscu cząsteczka się rozpada a w innym jony się łączą budując cząsteczkę wody. Na rysunku wygląda to jakby jon H+, ta jasna szara kuleczka, skakał z jednej cząsteczki do drugiej. Nie jest to błędne myślenie. W rzeczywistości wolne jony H+ w roztworze nie występują, natychmiast tworzy się jon hydroniowy H3O+ albo inny związek. W rozważaniach i wzorach często spotyka się zapis, że woda ulega dysocjacji w uproszczony sposób H2O ⇔ H+ + OH-. Myślę, że w rozważaniach będzie łatwiej posługiwać się tym uproszczeniem. Zatem jak zauważysz we wzorach H+ to w rzeczywistości jest to jon hydroniowy H3O+. Dysocjacja jonowa jest to reakcja chemiczna i można wyrazić ją za pomocą iloczynu jonowego Kw. Okazuje się, że ta reakcja przebiega na pewnym poziomie równowagi. Można ją zapisać za pomocą liczb. Skracam trochę drogę przez mękę i pomijam równanie stałej reakcji. Jeżeli jesteś zainteresowany i chcesz dowiedzieć się więcej to w [2] lub [1] ten temat jest omówiony bardzo szczegółowo, nie chcę przepisywać książek a przedstawić wynik rozważań. Kw=[H+][OH-] Kw = 1,0 * 10-14 w temperaturze ~25°C W określonych warunkach Kw jest stałe, oznacza to, że balans stężeń poszczególnych jonów musi być zachowany. Jeżeli zaburzysz równowagę jonów, przykładowo dolewając trochę kwasu co wprowadzi jony H+, to stężenie jonów OH- zmniejszy się. Równanie nadal będzie spełnione. Działa to w dwie strony, dodając silną zasadę po pewnym czasie zmniejszy się stężenie jonów [H+] W czystej wodzie stężenie jonów [H+] i [OH-] jest takie same. Zatem chcąc policzyć stężenie jednej grupy wystarczy podstawić ją dwukrotnie do wzoru Kw = [H+] * [H+], dalej [H+] = pierwiastek(Kw) = 1,0 * 10-7. W czystej wodzie tyle samo wyniesie stężenie jonów [OH-]. Dygresja: W czystej wodzie stężenie jonów jest bardzo małe. Uruchom wyobraźnię. W paczce drożdży płynnych Wyeast znajduje się 100 miliardów komórek drożdżowych. Gdyby założyć, że zachowują się tak jak cząsteczki wody, to tylko 10 pojedynczych komórek ‘uległoby dysocjacji’. Jeżeli rozbudziłem ciekawość i chcesz się dowiedzieć więcej zapoznaj się z [2]. Wartość pH zacieru powinna być w granicach 5.2-5.6, bo w tym przedziale wypadkowa pracy enzymów jest najbardziej wydajna. Enzymy również pracują poza tym zakresem, jednak nie są już tak efektywne. Im dalej od optimum tym słabiej pracują. Jako piwowarzy, naszym celem jest stworzenie warunków, aby mogło zachodzić scukrzanie. Pierwszym czynnikiem jest temperatura, przerwy temperaturowe aktywują enzymy. Drugim, ale nie ostatnim, czynnikiem jest pH. Możemy pomóc, stabilizując je na optymalnym poziomie. Zalety optymalnego pH to większa wydajność. Lepsza praca enzymów, mniejsza szansa przedostania się łańcuchów skrobi do piwa. Filtracja może okazać się łatwiejsza na skutek dobrego rozłożenia betaglukanów i cukrów. Dodatkowo w niższym pH przedostanie się znacznie mniej garbników z łuski, to z kolei przełoży się pozytywnie na smak. Zwiększy się odfermentowanie piwa. Odczyn pH również ma wpływ na rozkład protein. Podczas gotowania będzie większy przełom, a to oznacza klarowniejsze piwo. Przy okazji do brzeczki dostanie się więcej związków azotu (FAN) poprawiających fermentację. Poprawi się również stabilność piany. Jednym słowem piwo będzie lepsze. Już wiesz na co wpływa pH i czemu warto dbać o jego optymalny poziom. To jest dobry moment na wprowadzenie definicji. Skala pH jest wskaźnikiem ilościowym kwasowości i zasadowości roztworów wodnych. Wartość bazuje na stężeniu jonów wodorowych [H+] Pojęcie pH wprowadził Søren Peder Lauritz Sørensen. Powyższa definicja jest uproszczona, ale w zupełności wystarczająca do celów piwowarskich. Jeżeli chcesz się dowiedzieć więcej to zerknij tutaj albo tutaj. Wartość pH określa się według poniższego wzoru: pH = -log([H+]) Mimo skomplikowanego zapisu jest to bardzo wygodne. Przed chwilą policzyłeś stężenie jonów [H+] i [OH-] w czystej wodzie, wynosi ono 1,0 * 10-7. Liczba jest bardzo mała i niewygodna w zapisie. Podstawiając ją do wzoru na pH otrzymasz 7. Prawda, że wygląda to lepiej? Jeżeli w wodzie rozpuścisz silny kwas, na skutek czego będzie wzrastała ilość jonów [H+] a malała [OH-], bo stała reakcji musi być zachowana, to wartość pH zacznie spadać. Na pierwszy rzut oka wydaje się to nielogicznie, coś dodałeś a wartość spadła. Zauważ, że stężenie wyrażone jest jako ujemny wykładnik 10-7 (to samo co zapis 1/107). Zatem jak przybywa jonów wodorowych, to potęga staje się coraz większa, prosta matematyka: 1/107 < 1/103 < 1/10 < 0. Dodatkowo, by pozbyć się minusa został postawiony on przed logarytmem. Ponieważ tak jest wygodniej. Na samym dole skali jest 100, podstawiając do wzoru, pH = -log(100) = 0. W drugą stronę dzieje się tak samo, aż do momentu gdy, nie będzie już jonów H+. Wtedy wartość wynosi dokładnie tyle co Kw, podstawiając do wzoru pH = -log(Kw) = 14. Takie są granice skali pH. Im bliżej 0 tym bardziej kwaśny odczyn. Im bliżej 14 tym bardziej zasadowy. Środek skali to odczyn obojętny i wynosi 7. Zatem pH również określa zależność pomiędzy stężeniami [H+] i [OH-]. Niektóre reakcje chemiczne wymagają, by stężenie jednych jonów było większę. Enzymy scukrzające, czyli amylazy, najlepiej się czują w pH około 5.5. Czyli jony H+ są w większości i biorą udział w reakcjach, które rozcinają długie łańcuchy skrobi. Dygresja: skala pH nie ma większego zastosowania w przypadku mocno stężonych kwasów i zasad. W domowym piwowarstwie masz jednak szansę spotkać się z tak mocnymi stężeniami w przypadku mycia lub dezynfekcji. Wtedy obowiązkowo rękawice na dłonie oraz okulary ochronne. Roztwór o pH = 0 otrzymasz poprzez rozpuszczenie 1 mola kwasu solnego (HCl) w 1dm3. Roztwór o pH = 14 otrzymasz rozpuszczając 1 mol wodorotlenku sodu (NaOH). Suchy żart chemiczny: NaOH - zasady ponad wszystko. Mol jest to jednostka liczności materii używana przez chemików. Spotkałeś się już zapewne z różnymi jednostkami jak tuzin, mendel, kopa, kwadrans. Mol jest to kolejna nazwa, tylko trochę większej wartości, wynosi 6,022140857(74)×1023 (liczba Avogadra). Mówiąc 1 mol kwasu solnego mam na myśli około 6×1023 cząsteczek HCl. Mole są bardzo wygodne w przypadku reakcji chemicznych. Reagując 2 mole wodoru z 1 molem tlenu powstaje 1 mol wody (2H2 + O2 ⇔ 2H2O). Mole na wagę oblicza się również w prosty sposób, używa się do tego tabel z masą molową pierwiastków. Najczęściej spotykane cząsteczki są już skatalogowane. Przykładowo 1 mol wody waży około 18 gramów. Skala pH to skala logarytmiczna. Różnica między pH = 4 a pH = 5 to 10 krotna różnica stężeń. Pomiędzy pH = 3 a pH = 6 jest tysiąckrotna. Każdy jeden punkt przyrostu wartości pH powoduje 10 krotną różnicę w stężeniu, przesuwa rząd wielkości o 1. Pomiędzy odczynem neutralnym a skrajnym jest 10 milionowa różnica stężeń. Dygresja: Zerknij do tego artykułu by dowiedzieć się więcej o logarytmach. Warto, bo dowiesz się takich ciekawostek, że nasze zmysły również działają w oparciu o tę skalę. Wszędzie tam gdzie jest roztwór wodny można mówić o pH. W przypadku wielu produktów, które nas otaczają i są zbudowane głównie z wody jesteś w stanie wyznaczyć pH. Żywność, elektrolit baterii, nasze płyny ustrojowe, środki czystości. Nie będę się rozpisywał. Grafika powie o wiele więcej. Piwo można umieścić gdzieś pomiędzy octem a mlekiem. Wartość pH jest ważna. Pozwala stwierdzić jak i czy w ogóle enzymy pracują. Jednakże miej na uwadze, że jest to wskaźnik, który wynika z szeregu reakcji chemicznych. W piwie są to reakcje, na skutek których pH ciągle maleje, od samego początku procesu przygotowywania piwa. Żeby nie było tak łatwo, są również reakcje, które temu przeciwdziałają. Czas wprowadzić najważniejszy parametr wody w naszym hobby, czyli alkaliczność. 4. Alkaliczność z punktu widzenia piwowara Alkaliczność (zasadowość) wody, jest to właściwość określająca zdolność do zobojętniania kwasów. Alkaliczność jest tym większa, im więcej rozpuszczonych jest w wodzie węglanów i wodorowęglanów. Kolejny raz przedstawiłem uproszczoną definicję, tutaj masz szczegółową. Uwaga: alkaliczność nie zależy od współczynnika pH odczytanego z raportu wody, za chwilę to wyjaśnię. Z punktu widzenia piwowara alkaliczność możesz traktować jako opór brzeczki przed przed zmianą pH. Zauważ, że napisałem brzeczki, a nie samej wody, bo również słód w pewnym zakresie ma wpływ na spadek pH poprzez swoje właściwości buforujące. Alkaliczność możesz sobie wyobrazić jako gąbkę do mycia. Jest w stanie wchłaniać płyn, ale tylko do pewnego momentu. Im większa gąbka tym więcej jest w stanie wchłonąć. Po przekroczeniu pewnej objętości nie jest w stanie przyjąć nawet pojedynczej kropli. W tej analogii płyn traktuj jako jony H+ a gąbka to węglany wiążące te jony. Podczas zacierania, pH zacieru spada, staje się on coraz bardziej kwaśny. Dzieje się to głównie na skutek reakcji fosforanów zawartych w słodzie z wapniem. Fosforany stanowią około 1% wagi słodu. Jest ich bardzo dużo w stosunku do wapnia. Spadek pH będzie możliwy do momentu, aż nie zabraknie wapnia. Reakcja jest jednokierunkowa i wygląda tak: 10Ca2+ + 12HCO3- + 6H2PO4-1 + 2H2O → Ca10(PO4)6(OH)2 + 12CO2 + 12H2O + 2H+ Fosforany H2PO4-1 reagują z rozpuszczonym wapniem Ca2+ i wodorowęglanami HCO3 , efektem jest hydroksyapatyt, który się strąci i osiądzie, dwutlenek węgla, woda oraz kationy H+ powodujące spadek pH podczas zacierania. Ta reakcja pochłania wapń w pierwszych kilkunastu minutach zacierania [1]. To jest główny powód, dla którego warto poczekać z pomiarem pH około 15 minut. Mówiąc o alkaliczności wody, tak naprawdę mówimy o dwutlenku węgla rozpuszczonym w wodzie. Dwutlenek węgla dostał się do wody na kilka sposobów m.in. z atmosfery. Rośliny podczas oddychania również wytwarzają dużo CO2. Jest też odzyskiwany z minerałów zawierających węglany, przez które woda się sączy. Rozpuszczalność dwutlenku węgla jest stosunkowo mała i zależy od temperatury oraz ciśnienia. W temperaturze pokojowej w jednym litrze wody rozpuszczone jest około 0.5mg CO2. Obniżając temperaturę do bliskiej 0 - dwutlenku węgla rozpuści się dwukrotnie więcej. Wody głębinowe, gdzie panuje większe ciśnienie i niższa temperatura mają w sobie rozpuszczone dużo więcej dwutlenku węgla aniżeli wody powierzchniowe. Dwutlenek węgla w wodzie może występować w postaci rozpuszczonej CO2(aq). Albo być uwięziony w węglanach. Niewielka część rozpuszczonego dwutlenku reagując z wodą tworzy kwas węglowy H2O + CO2(aq) ⇔ H2CO3. Jest to słaby kwas i dysocjuje (rozpada się na jony w roztworze wodnym) w dwóch reakcjach. H2CO3 ⇔ HCO3− + H+, kwas węglowy rozpada się na wodorowęglan oraz kation hydroniowy HCO3− ⇔ CO32− + H+, wodorowęglan rozpada się na węglan oraz kolejny kation hydroniowy. Kwas węglowy i sposób w jaki się rozpada daje możliwość rozpuszczenia się w wodzie wapnia oraz magnezu. Gdy woda sączy się przez pokłady wapnia, kwas węglowy w niej zawarty dysocjuje oddając węglany. Te chętnie wiążą się z wapniem. Powstaje węglan wapnia CaCO3 (CaCO3 ⇔ Ca2++ CO32-). Płynąc przez dolomity, oprócz wapnia zyska również magnez. Pod ziemią, gdzie panuje większe ciśnienie, rozpuszczone jest więcej dwutlenku węgla i minerałów. Wszystkie węglany rozpuszczone w wodzie składają się na alkaliczność. Reakcje chemiczne mają to do siebie, że przebiegają na pewnym poziomie i w równowadze. Wapń zawłaszczył sobie cześć węglanów. Zatem reakcje będą dążyły do równowagi. Zwolni się trochę miejsca, powstanie nowy kwas węglowy. I znowu zostanie wypłukane trochę wapnia w postaci CaCO3. Po pewnym czasie reakcję znajdą punkt równowagi. Powyżej przedstawiłem uproszczony cykl węglanowy. Sekwencja reakcji chemicznych dążąca do równowagi. Rysunkowo można przedstawić to tak [1]: Układ będzie zawsze dążył do równowagi, oznacza to że ilość rozpuszczonego dwutlenku węgla musi być w harmonii z wszystkimi postaciami. Jeżeli zburzysz układ, przykładowo podnosząc temperaturę, co zmniejszy ilość CO2, to z czasem wytrąci się osad w postaci węglanu wapnia CaCO3. Jeżeli dodasz trochę węglanu wapnia CaCO3 oraz podniesiesz ciśnienie CO2, to węglan wapnia rozpuści się o wiele szybciej. Te reakcje nie dzieją się momentalnie, potrzebują czasu. Co więcej skutek widzisz codziennie. Kamień na słuchawce prysznica, kranie, sedesie, powstaje na skutek nagłego obniżenia ciśnienia wody. Rozpuszczalność dwutlenku węgla spada i układ węglanowy dążąc do równowagi wytrąca węglan wapnia. Sytuacja analogiczna dzieje się w czajniku elektrycznym, tam na skutek zmiany temperatury. Gospodyni domowa radzi: użyj octu to kamień nie będzie problemem. Jeszcze jedna uwaga. Postać węglanów zależna jest od pH i wygląda tak [1]: W zakresie pH zacierania, czyli pomiędzy 5.2 - 5.6 głównie będzie występował pod postacią kwasu węglowego. Stała pK1 wyznacza równowagę między kwasem węglowym a wodorowęglanami, pK2 jest to stała równowagi między węglanami a wodorowęglanami. W wodzie z kranu, gdzie pH najczęściej jest powyżej 7 dominującą postacią jest wodorowęglan. Na skutek reakcji wapnia z fosforanami, pH brzeczki spada. Układ węglanowy przesunął się w kierunku postaci kwasu węglowego. Pytanie jak to się ma do alkaliczności i tego oporu przed zmianą pH. Do sedna sprawy. Układ węglanowy to reakcje, które działają jak bufor. Bufor wiąże kationy H+, tym samym zapobiega zmianie pH. Oczywiście jest to w stanie zrobić tylko do swojej pojemności, później pH nadal będzie spadało. W brzeczce na skutek ciągłego obniżania pH pojemność tego bufora będzie przekroczona. Jednakże mimo przepełnienia zwiąże część jonów H+ i pH nie spadnie tak mocno. Cała sztuka to tak dobrać alkaliczność wody, by pH zatrzymało się w przedziale optimum zacierania. Druga zmienna tego układu równań, to odpowiednia ilość wapnia. W przypadku zacierania buforuje następująca reakcja: HCO3- + H+ ⇔ H2CO3. Wodorowęglany wchodzą w reakcję z kationami H+ pochodzącymi głównie z reakcji fosforanów z wapniem, powstrzymując spadek pH, do momentu aż są wodorowęglany wyczerpią. Bufor na przykładzie: dolewam trochę silnego kwasu do wody alkalicznej, bogatej w węglany. Okazuje się, że woda nie zmienia pH, bo węglany wyłapują i wiążą jony H+. Trwa to oczywiście do pewnego momentu, aż bufor się przepełni. Wtedy pH zacznie spadać w tempie dostarczania jonów H+. Na tej zasadzie działają testy kropelkowe, o których opowiem już niedługo w rozdziale o pomiarach wody. Im więcej węglanów w wodzie tym większe właściwości buforujące. Im większe wartości buforujące tym większy opór przed zmianą pH. W praktyce oznacza to, że jeżeli wybierzesz wodę bardzo alkaliczną i zrobisz lekkie jasne piwo, to może okazać się, że pH jest dalekie od optimum. Enzymy będą pracowały o wiele gorzej, zacieranie będzie trwało długo i może zabraknąć im wapnia przez co nie skończą pracy. Zostanie sporo skrobi. W skrajnych przypadkach może się nie udać kompletnie. Podobnie w przypadku wybrania wody mało alkalicznej i warzenia piwa z dużą ilością ciemnych i karmelowych słodów. Kwas zawarty w słodach pochodzi głównie z reakcji Maillarda i dodatkowo obniża pH. To oznacza, że pH zacieru może spaść za nisko i ponownie enzymy będą miały problemy z pracą. Dygresja: Odzyskanie równowagi w cyklu węglanowym może zająć trochę czasu. Większość tych reakcji nie jest demonem prędkości. Dlatego modyfikacje wody, zwłaszcza gdzie używane są węglany warto przeprowadzać kilka godzin przed warzeniem. Będzie to miało jeszcze jedną zaletę. W przypadku gdy Twoja woda jest dezynfekowana związkami chloru, to w kilka godzin większość chloru zleci i piwo będzie lepsze. W praktyce, policzenie powyższego jest żmudne i łatwo o pomyłkę. Na ratunek przychodzi Paul Kolbach, dokonał on pewnego odkrycia, znalazł pewną zależność. 5. Twardość wody Zanim przejdę od odkrycia Kolbacha, muszę powiedzieć czym jest twardość wody. Będzie potrzebna, aby policzyć ilość wapnia i magnezu w wodzie. Alkaliczność to głównie kompleksy węglanów z wapniem i magnezem (CaCO3, MgCO3). W wodzie oprócz węglanów rozpuszczone są sole mineralne. Najważniejsze w piwowarstwie to oczywiście sole wapnia i magnezu. Najczęściej w postaci siarczanu wapnia CaSO4 inaczej gipsu, chlorku wapnia CaCl2, siarczanu magnezu MgSO4 oraz chlorku magnezu MgCl2. Stężenie wapnia jest najczęściej 4-5 krotnie większe od stężenia magnezu. W wodzie pitnej występują również inne sole. Jednakże jest ich dużo mniej w porównaniu do wyżej wymienionych. Cała potrzebna teoria już jest, czas ubrać to w definicję: Twardość wody jest to suma stężeń kationów wapnia [Ca2+] i magnezu [Mg2+]. Twardość wody można podzielić na: węglanową/przemijającą - w tym przypadku wapń i magnez związany jest z węglanami (CaCO3, MgCO3). Twardość tą łatwo zmniejszyć, chociażby poprzez przegotowanie wody. niewęglanową/trwałą - są to pozostałe sole, z którymi związał się wapń i magnez . Będą to głównie chlorki i siarczany (CaSO4, CaCl2, MgSO4, MgCl2), ale też zdecydowanie mniej liczne azotany i fluorki. Twardość węglanowa to nie to samo co alkaliczność. Twardość liczy stężenia wapnia i magnezu, alkaliczność zajmuje się węglanami. W rachunkach współdzielą te same związki czyli węglan wapnia i magnezu, ale parametr twardości bierze pod uwagę kationy Ca2+ i Mg2+, natomiast alkaliczność anjony CO32- reagujące z kationami [H+]. Dygresja: Zakłady uzdatniania wody dbają o nasze zdrowie jako populacji, nie koniecznie o kondycję drożdży w Twoim fermentorze. To co pijemy z kranów ma związki, które są bezpieczne i potrzebne ludziom. Zatem nie uświadczysz takich soli jak chlorek cynku ZnCl2, który jest potrzebny drożdżom. Warto, abyś dodał trochę pożywki piwowarskiej, przynajmniej do startera, która zawiera cynk. Cynk jest potrzebny drożdżom do namnażania. Masz już kilka warek na koncie? opanowałeś warsztat, ale problemy z długim startem drożdży? Spróbuj dodać pożywki z cynkiem, może pomóc. 6. Alkaliczność rezydualna RA Badania i eksperymenty Kolbacha doprowadziły do wyznaczenia zależności pomiędzy alkalicznością oraz reakcjami z wapniem i magnezem podczas zacierania. Odkrycie wskazało, że wapń oraz magnez powoduje obniżenie jej alkaliczności w przewidywalny, zatem obliczalny, sposób. W przypadku wapnia 3.5 jednostki tego metalu obniża alkaliczność o 1. W przypadku magnezu, aby obniżyć alkaliczność o 1 potrzeba aż 7 jednostek. Na tej podstawie można zapisać już wzór [1] alkaliczności rezydualnej RA. Jest to alkaliczność z którą trzeba się zmierzyć. Czyli tak dobrać parametry wody, by pH zacieru zatrzymało się w optimum. mEq/L RA = mEq/L Alkaliczność- (mEq/L Ca/3.5 + mEq/L Mg/7) W powyższym wzorze występue jednostka mEq/L są to miliekwiwalenty. W naszych raportach wody częściej spotykana konkretna jednostka ppm (mg/l) jako CaCO3. Porównanie jakichkolwiek wartości ma sens, jeżeli są w tej samej skali/jednostkach. Waga 10 kilogramów, to nie to samo co 10 funtów. Prędkość 10 metrów na minutę, nie jest taka sama jak 10 mil na godzinę. Trzeba te wartości znormalizować, sprowadzić do wspólnej jednostki, albo wyrazić jedną jako drugą. Można też znaleźć wspólny punkt odniesienia. Tym właśnie jest mEq/L. Jeżeli chodzi o alkaliczność oraz stężenia jonowe, to wygodnie jest posługiwać się wagami, bo wiadomo ile tego dodać, bez zbędnego przeliczania moli na wagę. Waga wyrażona jako ppm lub inaczej mg/l jest chyba najczęściej stosowana w przypadku roztworów wodnych. Aby było ciekawiej, w przypadku alkaliczności przelicza się ją jako CaCO3 i ma to sens. Chodzi o ilość substancji, która przereaguje. Alkaliczność jest to opór przed zmianą pH, ale można na nią spojrzeć trochę inaczej. Alkaliczność pochłania jony H+ do momentu, aż nie jest w stanie ich więcej przyjąć. Po przepełnieniu pH spada. Jony H+ to nic innego jak kwas. Ustalam punkt odniesienia powiedzmy pH = 4.5 i dodaję kwas powoli, aż osiągnę ten wynik. Wyszło mi X miligramów tego kwasu. Gdybym użył innego kwasu to wyszłoby Y miligramów, nadal brak jednoznaczności. Dlatego potrzebny jest kolejny krok, punkt odniesienia. Mając ilość tego kwasu mogę teraz policzyć ile minimalnie miligramów CaCO3 potrzeba, aby ta sama ilość kwasu przereagowała calkowicie z węglanem wapnia. Nieważne, który kwas wybiorę, ilość CaCO3 wyjdzie taka sama. Ta minimalna ilość, to jest właśnie odpowiednik alkaliczności wyrażonej w ppm (mg/l) jako CaCO3. Pozostaje jeszcze wapń i magnez. Są w postaci stężeń. Trzeba je przeliczyć na mg/L. Tabele chemiczne w rękę i sprawdzam ile waży pierwiastek Ca a ile Mg. Na podstawie stężeń i wagi pierwiastka można obliczyć całkowitą wagę. Ostatecznie mam taką formułę: RA = Alkaliczność - (Ca/1.4 + Mg/1.7) Rezydualna alkaliczność (RA) oraz alkaliczność, wyrażona jest w ppm jako CaCO3, wapń oraz magnez w ppm. Teraz już można posługiwać się wygodnymi wagami. Przykład. Raport wody wymienia: wapń Ca = 70 ppm, magnez Mg = 14 ppm, alkaliczność = 80 ppm jako CaCO3. Ze wzoru wychodzi RA = 80 - (70/1.4 + 14/1.7) ~= 28. Wartość 28 jest to alkaliczność rezydualna, z którą musisz się zmierzyć modyfikując wodę lub też dobierając odpowiedni styl piwa. O tym za chwilę. Jeżeli woda będzie mało alkaliczna, czyli zawiera mało węglanów, natomiast zawartość siarczanów i chlorków będzie podwyższona, to RA może spaść poniżej 0. Jest to jak najbardziej poprawny wynik. Zanim przejdę do modyfikacji wody muszę opowiedzieć jeszcze o wpływie słodu na alkaliczność oraz o współczynniku ilości wody do słodu w kotle zaciernym. Badania Kolbacha uzupełnili Troester, Bies oraz A.J. deLange. Aby wiedzieć, kto miał jakie zasługi to proszę zapoznaj się z [1], w tym artykule przedstawię tylko wyniki badań. Pierwszym wynikiem eksperymentów było odkrycie, że stosunek zasypu do ilości słodu, ma wpływ na alkaliczność rezydualną. RA będzie większe w zacierze gęstszym. Tabela przedstawia wartość RA dla słodu pilzneńskiego i monachijskiego. Każdy wiersz to gęstość zacieru od 2 litrów do 5 litrów na kilogram. Robiłeś kiedyś RISa? Na 100%, by mieć większy ekstrakt robiłeś gęstszy zacier. Tym samym również miałeś większe RA. W tym stylu jest to bardzo dobre, ponieważ duża ilość kwasów z ciemnych słodów została zobojętniona i pH nie spadnie za nisko. W drugą stronę. Jakbyś zrobił bardzo gęsty zacier i super jasne piwo, wtedy pH może stabilizować się ponad optimum. Przy zasypie 3:1 - 4:1 nie ma spektakularnej zmiany RA. Co więcej taki współczynnik również jest bardziej optymalny dla amylaz (rozpuszczalność cukrów jest lepsza w rzadszym zacierze). W przypadku jeżeli zacierasz w kociołku automatycznym, na skutek mocnego rozrzedzania wpływ na RA będzie mniejszy. Gęstość zacieru pozwoliła wyciągnąć wnioski i zapewne przynieść duże oszczędności dużym graczom. Przyszedł czas na taki szczegół jak grubość śruty wpływa na właściwości buforujące. Nie ma już tak spektakularnych wyników, ale można zauważyć, że bardzo drobno ześrutowany/sproszkowany/mączny (pulverized) słód bardziej podnosi RA aniżeli śrutowanie grube. Przyjrzyj się poniższej tabeli. Ponownie słód pilzneński i monachijski. Szczelina śrutownika od mąki/proszku do 1.2 mm. Zatem bardzo drobna śruta nieco więcej podnosi RA. Znowu duzi gracze oszczędzają. My piwowarzy, może mali co do skali ale wielcy co do jakości, możemy również zaoszczędzić. Masz śrutownik? - zacznij śrutować trochę drobniej, ale nie przesadź na tyle, że zatrzyma Ci filtrację. Będzie większa ekstrakcja i trochę większe RA, co jest dobre w przypadku ciemniejszych piw. Przyszedł czas na kolejne badanie. Jak rodzaj/typ słodu wpływa na kwasowość/zasadowość zacieru. Przyjrzyj się tabeli. Dokładną analizę tabeli poznasz w [1]. Skupię się tylko na dwóch kolumnach. Zerknij w kolumnę pH oraz koloru. Zauważ relację, im ciemniejszy słód, tym pH było niższe. Można też powiedzieć, im ciemniejszy słód tym większego RA wymaga, by pH nie spadło za nisko. Wnioskiem z eksperymentu jest to, że piwa z dużą ilością słodów ciemnych i karmelowych muszą mieć wodę bardziej alkaliczną. Inaczej pH może spaść za nisko i efektywność zacierania będzie mniejsza. W przypadku piw jasnych woda powinna być mniej alkaliczna. Zadaniem piwowara jest dobranie tak alkaliczności wody oraz głównie wapnia, mniej magnezu, aby pH zatrzymało się na oczekiwanym poziomie, pomiędzy 5.2 a 5.6. Alkaliczność oraz ilość wapnia jest powiązana ze sobą przez równanie rezydualnej alkaliczności RA. Rodzi się pytanie, czy nie da się tego wszystkiego jakoś powiązać? Otóż da się, za pomocą koloru piwa. Nie jest to żart. Im ciemniejszy kolor tym więcej kwasowości pochodzących ze słodu. Nie trzeba przeliczać proporcji słodów ciemnych/specjalnych/karmelowych. Wystarczy docelowy kolor piwa by zobaczyć jakiej alkaliczności rezydualnej potrzeba. Formuła która łączy to wszystko: SRM = 0.14 * RA (jako CaCO3) + 5.2 Pełne złote a skromne, chyba że ciemne, ale też skromne. Kolor piwa powiązany jest z alkalicznością rezydualną, prawda że piękne? Przykład, aby lepiej zrozumieć. Załóżmy, że z wyliczeń, bez żadnych modyfikacji wody, wyszło RA = -10 jako CaCO3. Podstawiasz do równania: SRM = 0.14 * -10 + 5.2 = 3.8. Około tego koloru mieszą się piwa pszeniczne, belgijskie, PA i IPA. Poszukaj w Internecie tabel, które wymieniają style piwa pogrupowane po SRM i zobacz jakie piwa możesz warzyć bez modyfikacji wody. Wcale bym się nie zdziwił, że są to piwa, które Ci smakują i zawsze wychodzą najlepiej. W moim przypadku, gdzie RA mam wysokie, wchodzą w grę piwa o kolorze ciemny bursztyn oraz brązowe. Faktycznie, jak robiłem dunkelweizen oraz szkota, to pH trafiło w optimum. Żeby nie było za łatwo. Kolor piwa trudno ‘trafić’, do tego potrzeba trochę praktyki i doświadczenia. Nawet jeśli kalkulator podał konkretną wartość, nie zawsze taki kolor wyjdzie. Są różne słodownie, różne partie słodu. Słody ciemne mają szeroki zakres widełek koloru podawanego przez producenta. Dlatego nie męcz się z trafieniem koloru w punkt, zawsze możesz dokonać małej korekty kwasem. Przy małej odchyłce uzyskanego koloru od zamierzonego i tak najczęściej trafisz w optymalny przedział pH. Wartość RA łatwo wyznaczyć posługując się nomogramem zaproponowanym przez Johna Palmera w Książce How To Brew [3]. Zamiast liczyć, można rysować. Nomogram również pomoże w doborze koloru piwa i modyfikacji wody pod konkretny kolor. Bezpośredni link do nomogramu (PDF). Drukuj bez dostosowania lub w skali, bo inaczej może nie wyjść. Wygląda to tak: Kilka słów wyjaśnień. Wszystkie wartości, które otrzymasz musisz przeliczyć na odpowiednik CaCO3 (wyjątek alkaliczność, która może być jako HCO3). Kolorem jasno niebieskim są oznaczone widełki, jakie woda przeznaczona do warzenia powinna mieć. Są to wartości zalecane, nie obligatoryjne. Przykładowo historyczna woda pilzneńska wg literatury ma około 10 ppm wapnia i piwa jakoś wychodzą. Obecnie przy warzeniu pilsa dobre browary biorą poprawkę ze względu na jakość współczesnych słodów. Pokaże na przykładzie: Raport wody w jednostkach przeliczonych na ppm jako CaCO3 wygląda tak: wapń: 70, magnez: 15, całkowita alkaliczność: 48. Oznaczam wapń, magnez oraz alkaliczności na odpowiednich osiach nomogramu. Następnie rysuję linię od punktu wapnia do magnezu. Linia ta przetnie linię efektywnej twardości wody, punkt przecięcia uwzględnia już wpływ wapnia i magnezu. Rysuję kolejną linię od punktu przecięcia poprzez punk całkowitej alkaliczności. W efekcie przeciąłem linię RA i tym samym wyznaczyłem jej wartość. Na górze ponad wartością masz orientacyjne kolory piwa, które pasują do RA. Tak wygląda to w praktyce: Linia niebieska przecina wartość magnezu oraz wapnia odczytane z raportu wody, lub zmierzone testami. Prowadzę linię zieloną od punktu przecięcia efektywnej twardości poprzez całkowitą alkaliczność aż do przecięcia osi RA. Spoglądam w górę nad punktem i widzę, że optymalnie będzie jasne piwa do delikatnie bursztynowych. Mogę też wartość RA podstawić do wzoru SRM i mieć konkretną wartość. Jeżeli zechcę uwarzyć piwo ciemniejsze, to mogę do wody dodać kredy. Wtedy wzrośnie mi alkaliczność wody oraz ilość wapnia. O ile? Cóż mogę to obliczyć (rozwiązanie dla nerdów), zmierzyć po fakcie (rozwiązanie dla hazardzistów). Wystartować od zera, czyli użyć wody destylowanej lub RO. Mogę też posłużyć się pomiarem przed dodaniem czegokolwiek a następnie kalkulatorem. Jeżeli masz dokładny raport wody, to może on zastąpić pomiar. Podsumowując, formuła: SRM = 0.14 * RA (jako CaCO3) + 5.2 łączy w sobie wiele procesów chemicznych zachodzących podczas warzenia z kolorem piwa. Jeżeli wyznaczysz alkaliczność rezydualną, to będziesz widział w jaki kolor piwa celować, by pH zacieru było bliskie optimum. Trudnością jest trafienie z kolorem, ale w tym pomaga praktyka oraz większość programów do układania receptur. Warzenie piwa w jednym kolorze, mimo że dobrego, szybko się znudzi. Czas zacząć modyfikować wodę, by warzyć dowolne piwo i trzymać pH zacieru w optimum. 7. Modyfikacja wody Dostosowanie składu wody nie jest trudne. Podstawiasz dane w kalkulatorze i masz wyniki. Mówię jak najbardziej serio. Zachęcam do korzystania z kalkulatora online lub wbudowanego w Twój ulubiony program. Jeżeli jednak chcesz poznać, co znajduje się pod maską kalkulatorów, to zapraszam do dalszego czytania. Już wspominałem, że w naturze trudno jest spotkać wolne atomy. Raczej są to cząsteczki. Dodając je do wody dysocjują i rozpuszczają się. Do wody dodajemy sole mineralne aby podnieść poziomy wybranych jonów. Po dodaniu, nie można już ich usunąć w prosty sposób. Dlatego woda przygotowywana jest w dwóch etapach - mówię ciągle o piwowarstwie domowym. Na wstępie jest zmiękczana, spada twardość i alkaliczność do takiego poziomu, z którego za pomocą minerałów można zbudować pożądany profil. Żeby było trudniej, najczęściej wodę do zacierania traktuje się inaczej jak tą do wysładzania. Woda, którą będziesz wysładzał powinna być odpowiednio miękka, mało alkaliczna i najlepiej jakby potraktować ją kwasem aby obniżyć pH do poziomu około 5.5. Taki odczyn nie będzie płukał garbników. Jeżeli woda do wysładzania będzie mocno alkaliczna i będzie zawierała dużo wapna i miała wysokie pH, to nie dość, że wypłukasz sporo garbników, które powodują szorstkość odbioru piwa i ściąganie w ustach, to do piwa przedostanie się dużo wapnia. Ten może powodować mętność piwa, w skrajnych przypadkach gushing (tworzy małe kryształki ze szczawianami, super nukleatory pozwalające CO2 szybko przejść z postaci rozpuszczonej do lotnej). Dodatkowo bufor mocno alkalicznej wody będzie zapobiegał dalszemu spadkowi pH, to podnosi trochę ryzyko infekcji. Niższe pH jest środowiskiem mniej przyjaznym mikrobom. Wstępne przygotowanie wody Najłatwiej i najrozsądniej zacząć od zera, czyli użyć wody pozbawionej soli. Możesz taką kupić w sklepie jako wodę demineralizowaną lub zakupić system RO. Z tego podejścia korzysta Tibek. Używa małego systemu odwróconej osmozy RO3. Woda z takiego systemu jest porównywalna z destylowaną. Czysta woda, czy to z RO, czy też demineralizowana zakupiona w sklepie wymaga dodania wszystkich potrzebnych soli. Niewątpliwą zaletą tego podejścia jest start, od tego samego poziomu, czyli od zera. Nie martwisz się raportami wody. Jednakże nie ma róży bez kolców. Na wstępie trzeba trochę wydać. Zakup systemu RO, to wydatek przynajmniej 150 zł (z kosztami przesyłki, oraz potrzebnymi przyłączami). Potem dochodzi wymiana filtrów, raz na pół roku. Co kilka lat trzeba wymienić membranę. Jeżeli zamierzasz modyfikować wodę i warzysz 10 standardowych warek w roku, to po około 2 latach RO będzie bardziej opłacalne jak kupowanie najtańszej wody demineralizowanej. Oprócz aspektu finansowego jest również wygoda, a to przemawia za RO. Myślę, że jak zapytacie tibka to podpowie i doradzi co kupić. Dygresja: Jeżeli zdecydujesz się na zakup systemu RO (reverse osmosis, odwrócona osmoza) to zwracaj uwagę na współczynnik GPD. Zerknij tutaj aby dowiedzieć się więcej i policzyć czy Ci się to opłaca. Do celów piwowarskich wystarczy system RO3 75GPD. W zależności od ciśnienia w instalacji wodnej wytworzy około 3-4 litrów czystej wody na godzinę. Tanie systemy RO używają ciśnienia sieci wodnej do podtrzymywania zjawiska. Oznacza to, że na każdy wyprodukowany litr wody czystej zużyją kilka litrów wody, traktowanej jako odpad. Mimo tego koszt wyprodukowania wody przez system RO jest tańszy jak zakup w hipermarkecie. Drugim sposobem wstępnego przygotowania wody jest gotowanie. Gotowanie pozwala pozbyć się alkaliczności przemijającej. Wysoka temperatura redukuje ilość rozpuszczonego dwutlenku węgla. To zaburza równowagę układu węglanowego. Odczyn pH wody podnosi się a część węglanów strąca się jako osad sedymentując na dnie. Po przegotowaniu, wodę należy ostudzić i zdekantować, pozostawiając osad na dnie. Kosztem czasu i energii masz bardziej miękką wodę. Z tym podejściem wiąże się jeszcze jeden problem. Jak określić spadek twardości i alkaliczność? Możesz posiłkować się tabelą i próbować szacować. Z bardzo małej praktyki powiem Ci, że gotowanie wody jest uciążliwe. Trwa długo, trzeba potem delikatnie odbierać do kolejnego naczynia. Za to niewątpliwą zaletą jest bardzo szybkie pozbycie się chloru i jego lotnych związków podczas gotowania. Po przegotowaniu, zamiast szacować można również sprawdzić parametry. W tym celu najlepiej udać się do sklepu zoologicznego i kupić kropelkowe testy wody. Będziesz potrzebować dwóch. Pierwszy, to test KH-GH a drugi to Ca-Mg. Test KH mierzy twardość węglanową, test GH całkowitą. Test Ca wyznacza ilość wapnia, Mg magnezu. Testy te najczęściej podają wynik w stopniach niemieckich (°d). Trzeba je przeliczyć na mg/l jako CaCO3. Przeczylicznik jest prosty, wynik mnożysz przez 17.8. Testy kropelkowe działają na zasadzie liczenia kropli dodawanych do wody. Opiszę to na przykładzie testu KH. Woda, jak już wcześniej powiedziałem, to środowisko buforujące. Opiera się przed zmianą pH do momentu, aż bufor się przepełni. Dodając powoli kropelki testera zmniejszasz pojemność bufora. Liczysz kropla po kropli delikatnie mieszając. W pewnym momencie bufor się przepełni i ta ostatnia kropla zmieni kolor roztworu. Ilość dodanych kropli, to wynik w stopniach niemieckich. Załóżmy, że dodałem 5 kropli i woda się zabarwiła. Następnie mnożąc wynik przez 17.8 otrzymując wynik około 90. Jest to całkowita alkaliczność wyrażona w ppm jako CaCO3 (mg/l jako CaCO3). Testy kropelkowe w zależności od producenta i Twojej wody wystarczą na 10-20 pomiarów. Przy przechowywaniu ich w lodówce i ograniczeniu do kontrolnego pomiaru raz na kwartał wystarczą na kilka lat. Koszt zakupu obu, to około 65 zł. Zerknij tutaj aby zobaczyć jak wygląda używanie testów kropelkowych w praktyce. Dygresja: Raporty wody, które publikują stacje uzdatniania, są wykonywane zanim woda trafi do miejskiego wodociągu, a do kranu są jeszcze kilometry. Po drodze może zmienić swoje parametry. Testy kropelkowe najczęściej wskazują trochę większą wartość jeżeli chodzi o twardość i alkaliczność, tak samo jeśli chodzi o wapń. Woda płynie rurami pod większym ciśnieniem i potrafi jeszcze rozpuścić to co napotka po drodze. Im starsza instalacja, tym więcej soli i węglanów ma szansę dodatkowo się rozpuścić. To dobry powód, dla którego warto zakupić testy jeżeli nie masz systemu RO. Raporty wody również często pomijają alkaliczność wody, podając tylko całkowitą twardość. Rzadko jest wymieniony wapń i magnez jako oddzielna rubryka. Wtedy wypada zadzwonić albo napisać maila z prośbą o więcej danych. Możesz też próbować szacować, ale to już wybiega poza ramy tego artykułu. Trzecia możliwość, to rozcieńczenie. Ma tę przewagę nad gotowaniem, że jest o wiele szybsze i rozcieńcza wszystko w równych proporcjach. Minusem jest koszt, bo baniak 5 litrowej wody kosztuje około 3 zł. Ekonomiczność tego podejścia mocno zależy od Twojej wody. U mnie niestety czasem przy jasnych piwach muszę użyć kilku baniaków. W tej metodzie również przydadzą się testy kropelkowe, chyba że masz pełny raport wody. W swojej skromnej praktyce modyfikacji wody stosuję głównie tę metodę. W najbliższym czasie noszę się z zakupem taniego systemu RO3 głównie ze względu na wygodę. Powyższe metody nie są jedynymi. Są jeszcze inne techniki i narzędzia na zmiękczenie, zmniejszenie alkaliczności, zmianę proporcji minerałów. Przykładowo, możesz użyć wapna gaszonego, wymienników jonowych, natlenienia, nagazowania CO2 pod ciśnieniem. Chcesz dowiedzieć się więcej? sięgnij po [1]. Masz już przygotowaną wodę. Wybrałeś sobie profil, chociażby w tym miejscu (CaCO3 = HCO3- * 0.82). Czas teraz poznać czym można tą wodę zmodyfikować. Kwasy Rozpocznę od modyfikacji, którą stosowałem jako pierwszą i przez bardzo długi czas. Jest to dostosowanie pH wody za pomocą kwasu. Do tego celu przydatny jest pomiar, do pomiaru służą paski, a jeszcze lepiej phmetr. Phmetr Początkowo wystarczały mi paski, które z czasem zamieniłem na tani phmetr. Wydatek około 35 zł z kosztami przesyłki i to w polskiej dystrybucji. W opakowaniu oprócz urządzenia są dwie saszetki z buforem służące do kalibracji. Rozrabiasz je w oddzielnych naczyniach wg instrukcji i zanurzasz sondę. Następnie powoli nastawiasz śrubę kalibrującą. W obu roztworach musi wskazywać wartość odpowiadającą pH odczytaną z opakowania. Rozrobione bufory możesz przechowywać w szczelnie zamkniętych słoikach kilka miesięcy. Potem trzeba je zmienić na nowe. Dygresja: W tanich modelach, takich jak ten ze zdjęcia producent podaje, że po pomiarze pH sondę wystarczy przepłukać w wodzie demineralizowanej, zamknąć urządzenie i odłożyć. W ten sposób zniszczyłem swój pierwszy phmetr po kilku miesiącach prawdopodobnie uszkadzając sondę. Teraz robię inaczej. Sondę po pomiarze przepłukuję wodą demineralizowaną i przechowuję w roztworze KCl, najczęściej źródła podają roztwór 3 molowy (~22,5g w 100 ml roztworu), inne roztwór 1 molowy (producent powinien to wyszczególnić w instrukcji). Ważne jest aby sonda była w roztworze takiego elektrolitu wtedy membrana w niej zawarta nie wysycha. W zatyczce urządzenia jest miejsce na około 2 ml roztworu, w ten sposób sonda jest stale zanurzona i nie wysycha. Raz na jakiś czas, niestety, trzeba wymienić roztwór w zatyczce, bo powoli odparowywuje zostawiając trochę soli jako nalot. Nalot rozpuszcza się w ciepłej wodzie. Po każdym użyciu urządzenia, wstrzykuję świeży roztwór do zatyczki. Pamiętaj, aby z płynem w zatyczce phmetr trzymać pionowo, inaczej płyn się wyleje. Tak przechowywane urządzenie dłużej trzyma kalibrację. Mój model ma napis ATC na obudowie, funkcja kompensacji temperatur, z kórej przy pierwszym podejściu korzystałem nie tak jak trzeba. Jeżeli chcesz aby urządzenie długo Ci służyło, to moja rada jest taka: zawsze należy mierzyć próbki schłodzone do temperatury pokojowej. Nie wciskaj też phmetru w zacier, szybko się uszkodzi, odbieraj rzadką część, schłódź próbkę i dopiero po tym dokonuj pomiaru. Współczynnik pH zależny jest od temperatury, mierząc go w gorącym zacierze dostaniesz przekłamany wynik. Jak mocno? odpowiedź na to pytanie znajdziesz w [1]. Przypominam, pierwszy pomiar zacieru wykonujesz po około 15 minutach. Sam pomiar jest prosty. Włączasz urządzenie. Zanurzasz sondę i czekasz kilka sekund, aż pomiar się ustabilizuje, odczytujesz wynik i na jego podstawie decydujesz co dalej. Zakwaszanie wody Zakwaszanie jest łatwe, tanie i skuteczne. W piwowarstwie domowym używa się najczęściej kwasu fosforowego V (ortofosforowego) lub mlekowego. Z zachowaniem zasad bezpieczeństwa - w końcu to stężone kwasy. Powoli dodajesz kwas, zacznij od ilości 1ml, dokładnie mieszasz aby się rozpuścił i dokonujesz pomiaru. Powtarzasz iteracyjnie do momentu uzyskania wyniku. Kwasu możesz dodawać zarówno do zacieru jak i do wody przeznaczonej na wysładzanie. Używam kwasu fosforowego 75%, dozuję go strzykawką. Jeżeli odpowiednio zmodyfikowałem wodę, to korekta brzeczki najczęściej nie jest potrzebna. W innym przypadku wszystko zależy od alkaliczności Twojej wody. Możesz zużyć nawet kilka mililitrów. W przypadku wody do wysładzania wszystko zależy od alkaliczności. Może to również być kilka mililitrów, ciągle mówię o standardowych 20 litrowych warkach. Zatem dodawaj po 0.5 - 1 ml, mieszaj i sprawdzaj wynik. Kwas mlekowy, jest kwasem silniejszym od fosforowego. Dodaje się go w mniejszych ilościach. Zaletą kwasu mlekowego jest to, że pozwala robić piwa zakwaszane. Po rozcieńczeniu jest przyjemny w smaku w porównaniu do fosforowego. Nie muszę chyba mówić, że te roztwory muszą być trzymane w bezpiecznym miejscu z dala od dzieci. Stężenia kwasów są podane wagowo a nie objętościowo. Więc 1 gram kwasu 75% nie jest tym samym co 1 ml. Kwas fosforowy jest gęstszy od mlekowego i oba są gęstsze od wody. Zatem objętość ich będzie mniejsza aniżeli waga. Jony, aniony, kationy, będą z tego związki Zapewne zauważyłeś, że wszystko co do tej pory napisałem powyżej ma wpływ na wydajność i komfort pracy enzymów. Jednakże modyfikacja wody to również i smak. Krótka charakterystyka części jonów (po więcej, sięgnij koniecznie do [1]): Wapń (Ca2+). Zalecany poziom 50 - 200 ppm. Palmer nazywa go przyjacielem piwowara. Główny jon reagujący z fosforanami ze słodu powodujący spadek pH. Stabilizuje pracę enzymów. Wspomaga koagulację białek, wytrącanie się osadu i szczawianów. Ma również wpływ na metabolizm drożdży. Jeżeli warzysz w kociołku automatycznym, pomyśl nad dodaniem wapnia w procesie gotowania. W przypadku systemu gdzie wysładza się wodą, to przedostanie się go wystarczająco dużo do kadzi warzelnej. W przypadku kociołków, gdzie jest ciągła cyrkulacja, poziom wapnia może (nie musi) być bardzo niski, co może skutkować mętniejszym piwem lub gorszą fermentacją. Wapno ma wysoki próg wyczuwalności, nie uzyskasz raczej takiego poziomu na wodzie z kranu. W przypadku bardzo dużych stężeń smakuje trochę jak woda mineralna. Magnez (Mg2+). Zalecany poziom 0 - 40 ppm. Podobnie jak wapń, ma wpływ na obniżenie pH zacieru. Drożdże potrzebują około 5 ppm magnezu, taka ilość jest zawarta w słodzie, stąd woda może go nie mieć zupełnie. Niektóre style piwa wymagają go trochę więcej, są to głównie piwa mocno chmielone. Od stężenia 125 ppm wykazuje właściwości przeczyszczające. Powyżej 40 ppm, może być odbierany jako nieprzyjemny kwaśno-gorzki smak. Sód (Na+). Najczęściej są to jony wprowadzone przez przydomowe zmiękczacze wody. Woda zmiękczona sodem nie jest najlepszym wyborem w piwowarstwie. W małych stężeniach, poniżej 150 ppm może podnosić odczucie pełni. Ale jeżeli w wodzie pojawi się duże stężenie chlorków to mamy NaCl, czyli sól kuchenną i smak słony. Palmer podaje, aby ilość sodu nie przekraczała 100 ppm. Siarczany (SO42-). Przykładowo siarczan wapnia CaSO4, czy magnezu MgSO4. Ich zwiększona ilość odpowiada za jakość goryczki, robiąc ją bardziej stanowczą i wytrawną. W przypadku zbyt dużej ilości siarczanów smak piwa może stać się lekko mineralny. W przypadku stężenia 200-400 ppm odpowiada za wydłużenie czasu kiedy odczujesz chmielowość. Palmer również podaje, że browary niemieckie jak i czeskie, unikają dużych stężeń siarczanów, bo rujnują smak szlachetnych chmieli kontynentalnych. Chlorki (Cl-). W przypadku wody, są to związki metali z chlorem, przykładowo: chlorek wapnia CaCl2, chlorek cynku ZnCl. Lotne związki chloru powinny zostać z wody całkowicie usunięte. Albo w sposób chemiczny, albo poprzez odstanie przez kilka godzin, albo poprzez przygotowanie. Ilość chlorków nie powinna przekraczać 200 ppm. Odpowiadają za odczucie słodowości i pełni piwa. W dużych stężeniach mogą mieć negatywny wpływ na sprzęt, zwłaszcza wykonany ze stali nierdzewnej. Proporcja chlorków do siarczanów. Chlorki z siarczanami to duet smakowy. W teorii ważna jest ich proporcja. W praktyce czasem wychodzi inaczej. Aby poczuć w smaku wpływu tej proporcji, to ilość chlorków powinna być w zakresie 50 - 200 ppm, a siarczanów 50 - 500 ppm. W przypadku piw słodowych, siarczanów powinno być mało a chlorków kilka razy więcej. Piwa z umiarkowanym chmieleniem, dobrze sprawdzają się blisko równych proporcji. Jeżeli bardziej zależy Ci na wyciągnięciu chmielu, wtedy zwiększasz ilość siarczanów. Dygresja: Proporcje i ich dobór wyjdzie z czasem i praktyką, nie czuję się kompetentny, by doradzać konkretne poziomy. Sam patrzę na tą proporcję trochę przez palce. Przykładowo, lubię nie do końca stylowe AIPA, gdzie przewaga chlorków nad siarczanami jest znaczna, przynajmniej 2:1. Zupełnie inaczej, jak podaje literatura i przykłady niektórych świetnych piw. W naturze bardzo rzadko występują wolne jony. Kationy wapnia Ca2+ i magnezu Mg2+ w naszym przypadku związane są z kationami czy to w postaci chlorków, siarczanów czy też węglanów. Natura tak chciała i nie ma dyskusji. Zatem modyfikując wodę będziesz dostawał zarówno kationy jak i aniony. A to wymaga już lekkich obliczeń, które wykona za Ciebie kalkulator. Nie będę tego powtarzał, ponieważ nasza wiki opisuje w bardzo dobry sposób modyfikację wody. Poniżej przedstawię najczęściej używane modyfikatory, nazwy będą potrzebne w jednym przykładzie przy użyciu kalkulatora. Gips piwowarski, siarczan wapnia (CaSO4 · 2H2O). Wprowadza wapń oraz siarczany. Często stosowany przy warzeniu piw chmielowych. Kupujemy go w postaci proszku, mimo tego jest uwodniony. Czyli w strukturze posiada cząsteczki wody. Oznacza to, że przy przeliczeniu proporcji również musisz tę wodę uwzględnić. Kalkulatory zakładają, że dodajesz właśnie taką postać gipsu. Są jeszcze odmiany bardziej uwodnione (wtedy nie powinny nazywać się gipsem, sklepy piszą różnie). W takim przypadku kalkulatory źle podadzą ilości. Zatem zwracaj uwagę aby kupić dwuwodny, czyli gips. Chlorek wapnia (CaCl2). Wprowadza wapń oraz chlorki. Stosowany jako modyfikator w stylach słodowych. Sól kuchenna, chlorek sodu (NaCl). Wprowadza jony sodu oraz chlorki. Stosowana relatywnie rzadko (chyba, że mówimy o specjalnych piwach jak gose). Jest dobrym wyborem, jeżeli masz nisko sodową wodę i chcesz podbić słodowość. Kreda, węglan wapnia (CaCO3). Wprowadza wapń i powoduje, że woda staje się alkaliczna. Węglan wapnia ma bardzo małą rozpuszczalność. Warto go dodać na kilka godzin przed warzeniem, aby miał szansę lepiej się rozpuścić. Jego rozpuszczalność zwiększa dwutlenek węgla. Soda, wodorowęglan sodu (NaHCO3). Wprowadza sód i trochę alkaliczności. Stosowana raczej rzadko. Chlorek magnezu (MgCl2 · 6H2O). Wprowadza magnez i chlorki. Jest dość rzadko stosowany, ponieważ ilość magnezu w wodzie powinna być niska. Sprzedawany najczęściej w postaci uwodnionej. Sól gorzka, zwana solą epsom. Siarczan magnezu, (MgSO4 · 7H2O). Jako, że w wodzie stężenie magnezu nie powinno przekraczać 40 ppm, to jest stosowana bardzo rzadko. Wprowadza siarczki i magnez. Jest sprzedawana w postaci siedmiowodnej. Znowu trzeba brać to pod uwagę w obliczeniach. Dodawana jest czasem do wytrawnych nowofalowych IPA. Powyższe związki są tanie i bardzo trwałe pod warunkiem poprawnego przechowywania, czyli szczelnie zamknięte, bez wilgoci i w ciemnym miejscu. Jednakże miej na uwadze to, że jak sypiesz jedną łyżeczkę gipsu, to nie oznacza, że połowa tej łyżeczki to wapń a druga siarczany. Związki składają się z atomów, które mają różne wagi. Aby policzyć ile wagowo znajduje się konkretnego jonu trzeba sięgnąć do tablicy okresowej pierwiastków. Wzór rozkładasz na atomy i przypisujesz im wagę. W gipsie dwuwodnym zawarte są: Ca ~ 40u, S ~ 32u, O ~ 16u, H ~ 1u. Jednostka ‘u’ jest do pominięcia, ważna jest relatywna różnica w wadze, to pozwoli wyliczyć procentowy udział. Wiem, że jesteś ciekawy u = 1,66 * 10-24 g. Przykład: na łyżeczce jest 3 gramy gipsu. Zapis chemiczny wygląda tak: CaSO4 · 2H2O. Ważna uwaga, musi to być prawidłowy zapis stechiometryczny. Woda to: 2 atomy wodoru (H), jeden tlenu (O). Obliczenia: 2 * 1u + 16u = 18u. Siarczan wapnia to: 1 atom wapnia (Ca), 1 siarki (S), 4 tlenu (O). Obliczenia: 40u + 32u + 4 * 16u = 136u. Dwuwodna cząsteczka gipsu łącznie waży: 136u + 2 * 18 u = 172u. Wagowo woda stanowi około 21% (36/172 * 100%), zatem waży 3g * 0,21 = 0,63g. W nabranych 3 gramach gipsu jest 3g - 0.63g = 2.37g czystego siarczanu wapnia. Siarczan (SO4) waży 32u + 4*16u = 96u. Procentowo stanowi: 96/172 * 100% = 56%. Zatem siarczanów jest 2.37g * 0,56 ~= 1.33g. Wapnia w takim razie jest 2.37g - 1.33g ~= 1g. Ile to będzie mg/l czy też ppm? Aby to obliczyć bierzesz poszczególne wagi i dzielisz przez objętość wody. Morał z tego taki, że siarczan wapnia wagowo bardziej podnosi siarczany niż wapń. Tak właśnie wyglądają obliczenia kalkulatorów wody. Czas przyjrzeć się jednemu, a konkretnie kalkulatorowi od Brewers Friends. Zapoznaj się również z metodologią zamieszczoną pod rubrykami kalkulatora. Dowiesz się jak architekci podeszli do tematu i na czym bazowali. Kolejny przykład, tak będzie najprościej. Warzę dry stout. Celuję w około 19 litrów idealnie, aby przelać potem do kega typu cornelius. Drożdże wybiorę silnie flokulujące, mało chmielu, więc strat będzie niewiele. Użyję 4 kilogramów słodu, słód mi uwięzi około 4 litrów wody. Następnie gotowanie, odparuje około 4 litrów. Mało chmielu, więc 3 litry to będą straty. Ostatecznie potrzebuję 19 + 4 + 4 + 3 = 30 litrów wody. Będę zacierał w proporcji 4:1, więc do kotła warzelnego idzie 16 litrów wody, reszta czyli 14 litrów do wysładzania. Kalkulator pozwala mi zacząć od pełnego raportu wody lub od najprostszego, bazującego tylko na twardości ogólnej, alkaliczności oraz pH. Te trzy parametry wystarczą aby oszacować ile i jakich jonów jest w wodzie pitnej, bo stężenia określonych grup jonów wykazują właściwości korelacyjne (kolejny raz zapraszam aby sięgnąć do [1] lub [2]). Mój raport wody nie zawiera nic o alkaliczności, zatem kupiłem w sklepie zoologicznym test KH-GH. Wyszło mi, już po przeliczeniu na ppm jako CaCO3, że twardość całkowita GH wynosi około 370 ppm jako CaCO3, a alkaliczność KH 230 ppm jako CaCO3 Wybór stylu piwa nie był przypadkowy. Mam wodę alkaliczną i twardą. Dobra do piw raczej ciemniejszych, będzie mniej pracy. Jako profil docelowy wybrałem Dublin (Dry Stout). Korzystam z uproszczonego podejścia, nie będę przejmował się wszystkimi parametrami. Najważniejsze będzie osiągnięcie odpowiedniego poziomu alkaliczności oraz wapnia. Wodę do wysładzania będę rozcieńczał wodą demineralizowaną, więc tak naprawdę będą dwa źródła wody. Woda do warzenia - prosto z kranu. Pozwolę jej odstać noc aby pozbyć się lotnego chloru. Woda do wysładzania będzie rozcieńczona, więc ma inne parametry. Użyję 10 litrów wody demineralizowanej a brakującą część dopełnię kranówką. Chcę uzyskać wodę miękką, mało alkaliczną. Zatem rozcieńczenie wynosi około 70%. O tyle samo spadnie twardość i alkaliczność rozcieńczonej wody z kranu. Wartości wody do wysładzania to: GH = 110, KH = 70. Mam już wszystko. Profil wody możesz znaleźć pod tym linkiem. Lub używając kodu: JBBLGXV. Krok po kroku, jak wyglądał proces obliczeń w celu dostosowania wody. Przestawiłem się na jednostki z układu SI. Wyszło mi, że potrzebuję 30 litrów wody. Woda do zacierania 16 litrów, do wysładzania 14 litrów. Będę używał innej wody w obu procesach. Nie dysponowałem pełnym raportem. Ograniczyłem się do do pomiaru testem kropelkowym. Przeliczyłem ze stopni niemieckich na ppm jako CaCO3. Z pomiaru pH = 7.3. Warzę stouta, więc wybieram profil odpowiedni do stylu. Wybór uzupełnił mi wartości docelowe. Zamiast konkretnego wyboru możesz tam wpisać własne wartości, w które celujesz. Teraz cała trudność, trzeba tak dobrać sole i węglany, aby trafić jak najbliżej wartości docelowej. Delta powinna być jak najbliżej 0. Wartości zielone oznaczają, że jest dobrze. Tak jak mówiłem wcześniej: wartości magnezu oraz siarczanów są wyliczone w sposób przybliżony. Nie przejmuję się nimi. Wartość siarczanów odbiega do 53, jest na progu wyczuwalności. Nie chciałem rozcieńczać wody do zacierania, więc godzę się na lekkie odchylenie. Z wapnem i alkalicznością trafiłem tak jak trzeba. Wybrałem kredę do modyfikacji, bo zawiera oba jony, których mi brakuje. Kredy wyszło: 6.5 g. Wodę warto przygotować dzień przed warzeniem i kredę w niej rozpuścić, co jakiś czas mieszając, niestety podobnie jak węglan wapnia nie rozpuszcza się natychmiast. Brakowało trochę chlorków i sodu. Jony te zawiera sól kuchenna. Wystarczył 1 gram soli. Woda do warzenia gotowa. Czas na wysładzanie. Woda była rozcieńczona. Wpisałem wartości, które obliczyłem wcześniej. Woda miała za duże pH więc użyłem kwasu fosforowego V by ją zakwasić. Mam kwas 75%, więc taki ustawiłem. Kalkulator mi podpowiedział ile go potrzeba, przepisałem tę wartość. Docelowa była ustawiona na 5.4, nie ruszałem. Zaznaczyłem opcję, aby kalkulator uwzględnił powyższe wartości. Nic tylko warzyć. Jeżeli będziesz zaczynał od wody RO, to w uproszczonym raporcie wpisujesz wartość 0 dla KH i GH. Woda demineralizowana i RO nie będzie miała pH równego 7. Dlatego, że jest w niej trochę rozpuszczonego CO2, co za tym idzie będzie tam kwas węglowy. Zatem pH będzie poniżej 7. Jest to powód, dla którego woda demineralizowana nie nadaje się do kalibracji phmetrów. Zakończenie Jeżeli dotrwałeś do tego momentu i jeszcze nie śpisz, to jestem pełen podziwu. Dowiedziałeś się podstaw dotyczących wody w piwowarstwie domowym. Głównie w aspekcie wydajności. Chociaż też pojawiło się kilka zdań o wpływie składu wody na smak. Warto abyś teraz sięgnął po pozycję [1] i zobaczył, że temat ten jest trochę szerszy. Z pozycji [1] również dowiesz się, jak przygotowują i modyfikują wodę duzi gracze. Dlaczego wymienniki jonowe stosowane przez koncerny nie są takie złe. Co daje napowietrzanie wody, a co przepuszczanie dwutlenku węgla pod wysokim ciśnieniem. Jak działają bufory słodów i wiele innych ciekawych informacji. Mam cichą nadzieję, że powyższy artykuł przyczyni się do podniesienia wydajności w Twoim domowym browarze. Zużyjesz mniej energii i słodu. Będziesz nosił mniejsze ciężary a Twoje piwo stanie się jeszcze lepsze. Sam proces modyfikacji nie jest skomplikowany, zwłaszcza że wiesz już co w tej wodzie się dzieje. Dziękuję serdecznie recenzentom. Proszę kierujcie trudne pytania właśnie do nich ;). Dziękuję również Tobie, za poświęcony czas i do zobaczenia w następnym artykule. Na prośbę forumowiczów zamieszczam dodatkowo dokument w formacie PDF z powyższym artykułem. Możesz go pobrać tutaj: O wodzie w browarze domowym, bez lania wody .pdf. Możesz być zainteresowany również: Bank drożdży piwowarskich w domowych warunkach Odzyskiwanie drożdży z piwa niepasteryzowanego Skuteczność popularnych środków dezynfekujących na brettanomyces StarSan, tani i skuteczny środek dezynfekujący Wyjaśnienie jak działają enzymy podczas zacierania Cukier kandyzowany domowej produkcji Kilka słów o namnażaniu drożdży w starterze Jak długo przechowywać gęstwę Rehydracja drożdży suchych, temperatura ma znaczenie Prosty sposób na tanie i szybkie chłodzenie brzeczki latem Nie samym piwem człowiek żyje, czyli chmielona woda na upalne dni Zrób to sam, czyli jak wykonać mieszadło magnetyczne posiadając dwie lewe ręce Jeżeli zauważyłeś błąd to proszę zgłoś go jako prywatną wiadomość, by nie robić off-topu w komentarzach. Poprawię z adnotacją. Jeżeli błąd wymaga dyskusji, oczywiście komentuj.
- 54 odpowiedzi
-
- srm
- cykl hydrologiczny
- (i 15 więcej)